一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示:下列描述正确的是
| A.反应开始到10 s,用Z表示的反应速率为0.158 mol/(L•s) |
| B.反应开始到10 s,X的物质的量浓度减少了0.79 mol/L |
| C.反应开始到10 s时,Y的转化率为79.0 % |
D.反应的化学方程式为:X(g)+Y(g) Z(g) Z(g) |
纤维素还原法制取ClO2是将纤维素水解得到的最终产物C6H12O6与NaClO3在酸性条件下反应生成ClO2。下列叙述中正确的是
□C6H12O6+24NaClO3+12H2SO4=24ClO2↑+□CO2↑+18H2O+12Na2SO4
| A.方程式中产物CO2的计量数为6 |
| B.CO2是还原产物,ClO2是氧化产物 |
| C.氧化剂和还原剂的物质的量之比为4:1 |
| D.每生成1 mol CO2需转移24mol电子 |
已知氧化性Fe3+>Cu2+,向FeCl3、CuCl2的混合溶液中加入铁粉,充分反应后仍有固体存在,则下列判断不正确的是
| A.加入KSCN溶液一定不变红色 |
| B.剩余固体中一定含铜 |
| C.溶液中一定含Cu2+ |
| D.溶液中一定含有Fe2+ |
下列除杂的方法错误的是
| A.除去N2中的少量O2:通过灼热的Cu粉,收集气体 |
| B.除去SO2中的少量HCl:通入饱和NaHSO3溶液,干燥后收集气体 |
| C.除去Fe2O3固体中少量Al2O3:加入足量NaOH溶液,过滤、洗涤、干燥 |
| D.除去KCl溶液中少量MgCl2:加入适量NaOH溶液,过滤 |
下列实验现象和结论相符的是
| 操作及现象 |
结论 |
|
| A |
溶液中加入盐酸,产生使澄清石灰水变浑浊的无色无味气体 |
溶液中一定含有CO32- |
| B |
某溶液中加入硝酸银,产生白色沉淀 |
溶液中一定含有Cl- |
| C |
用洁净铂丝蘸取某溶液在火焰上灼烧,火焰呈黄色 |
溶液中有Na+,无K+ |
| D |
向某溶液中先加KSCN无明显现象,再滴氯水,溶液变红 |
溶液中一定含有Fe2+ |
对实验Ⅰ~Ⅳ的实验现象预测正确的是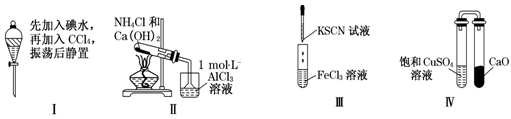
| A.实验Ⅰ:液体分层,下层呈无色 |
| B.实验Ⅱ:烧杯中先出现白色沉淀后溶解 |
| C.实验Ⅲ:试管中溶液出现红色沉淀物 |
| D.实验Ⅳ:放置一段时间后,饱和CuSO4溶液中出现蓝色晶体 |