(共9分)现有A、B、C、D、E、F六种短周期元素,原子序数依次增大。已知A与D、C与E分别同主族,D、E、F同周期;A、B的最外层电子数之和与C的最外层电子数相等,A与C形成的化合物常温下均为液态,A分别与E、F形成的气体分子电子总数相等。请回答下列问题:
(1)元素B在周期表中的位置 。
(2) A2C比A2E沸点高的原因是____________________________。
(3)写出同时含A、B、C、E四种元素的三种盐的化学式 、 、 。
(4)A2C的电子式为 ,C和D形成的一种化合物与A2C发生氧化还原反应,该反应的离子方程式为 。
(5)B元素的最高价氧化物的水化物与其氢化物反应的离子方程式 。
(6)在一定条件下,A、C的单质和A、C、D形成的离子化合物的水溶液可构成电池,该电池在放电过程中,电解质溶液的pH将________(填“增大”、“减小”或“不变”)。
下表是元素周期表的一部分, 针对表中的①~⑧种元素,填写下列空白: 
主族 周期 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0族 |
| 2 |
① |
② |
③ |
|||||
| 3 |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
 (1) 在这些元素中,化学性质最不活泼的是: _(填具体元素符号,下同)。
(1) 在这些元素中,化学性质最不活泼的是: _(填具体元素符号,下同)。 (2) 在最高价氧化物的水化物中,酸性最强的化合物的分子式是____________,碱性最强的化合物的分子式是_____________。
(2) 在最高价氧化物的水化物中,酸性最强的化合物的分子式是____________,碱性最强的化合物的分子式是_____________。 (3) 最高价氧化物的水化物显两性的是;写出它与盐酸反应的离子方程式。
(3) 最高价氧化物的水化物显两性的是;写出它与盐酸反应的离子方程式。 (4) 表示元素④与⑦形成的化合物的电子式。
(4) 表示元素④与⑦形成的化合物的电子式。 (5)表示元素①与③形成的化合物的电子式。
(5)表示元素①与③形成的化合物的电子式。
工业上合成氨是在一定条件下进行如下反应:N2(g) + 3H2(g) ≒ 2NH3(g),其部分工艺流程如下: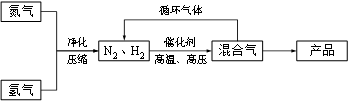
回答下列问题:
(1)已知: N2(g) + O2(g) 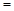 2NO(g)ΔH
2NO(g)ΔH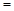 +180.5kJ/mol
+180.5kJ/mol
4NH3(g) + 5O2(g) 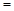 4NO(g) + 6H2O(g)ΔH
4NO(g) + 6H2O(g)ΔH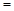 −905kJ/mol
−905kJ/mol
2H2(g) + O2(g) 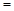 2H2O(g)ΔH
2H2O(g)ΔH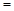 −483.6kJ/mol
−483.6kJ/mol
则N2(g) + 3H2(g) ≒ 2NH3(g)ΔH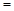 ________________。
________________。
(2)如果工业上,在一定温度下,将1.5 mol N2气体和6 mol H2气体通入到体积为1升的密闭容器中。当反应达到平衡时,容器内气体的压强为起始时的80%,则其平衡常数为_______。改变下列条件,能使平衡向正反应方向进行且平衡常数不变的是__________。
①增大压强②增大反应物的浓度③使用催化剂④降低温度
(3)合成氨反应的平衡常数很小,所以在工业上采取气体循环的流程。即反应后通过降低混合气体的温度而使氨气分离出来。这种分离物质的方法其原理类似于下列方法中的________(填编号),其理由是__________。
①过滤②蒸馏③渗析④萃取
(4)可以用氯气来检验输送氨气的管道是否漏气,如果漏气则会有白烟(成分为氯化铵)生成,该反应的化学方程式为__________。
(5)假如该厂生产氨水的物质的量浓度为20 mol/L,实验室若需用80 mL浓度为5 mol/L的氨水时,需取20 mol/L的氨水__________mL(用100 mL的容量瓶)。假如该氨水的 ,加入相同体积的盐酸时,溶液呈中性,则此盐酸的pH__________
,加入相同体积的盐酸时,溶液呈中性,则此盐酸的pH__________ (填“大于”、“小于”或“等于”)。
(填“大于”、“小于”或“等于”)。
丙烯是重要的工业原料,以丙烯为原料合称有机玻璃和药物喹啉的流程如下:
回答下列问题:
(1)结构简式A为__________,C为__________。
(2)①~⑩反应中,属于取代反应的有________(填序号,下同),属于消去反应的有_______,而⑦属于__________反应(填反应类型)。
(3)设计反应①、②的目的是____________________。
(4) 写出下列反应的化学方程式:反应②、反应⑤。
(5) D的同分异构体E能进行银镜反应,且分子结构中有两种化学环境氢,E的结构简式为_____________。
青铜矿(CuFeS2)是制取铜及其化合物的主要原料之一,还可以制备硫及铁的化合物。
(1)冶炼铜的反应为
8CuFeS2 + 21O2 8Cu + 4FeO + 2Fe2O3 + 16SO2
若CuFeS2中Fe的化合价为+2,反应中被还原的元素是_________(填元素符号)。
(2)上述冶炼过程产生大量SO2,下列处理方案中合理的是__________(填代号)。
a.高空排放 b.用于制备硫酸
c.用纯碱溶液吸收制Na2SO4 d.用浓硫酸吸收
(3)过二硫酸钾(K2S2O8)具有强氧化性,可将I−氧化为I2:S2O82− + 2I− → 2SO42− + I2;通过改变反应途径,Fe3+、Fe2+均可催化上述反应,试用离子方程式表示Fe3+对上述反应催化的过程:__________、__________。
(4)利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3)可制备Fe2O3,方法为:
①用稀盐酸浸取炉渣,过滤;②滤液先氧化,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得Fe2O3。
a.除去Al3+ 的离子方程式是____________________________;
b.选用提供的试剂,设计实验验证炉渣中含有FeO。
提供的试剂:稀盐酸稀硫酸 KSCN溶液 KMnO4溶液 NaOH溶液碘水
所选试剂为__________,证明炉渣中含有FeO的实验现象为____________________。
短周期元素A、B、C、D、E的原子序数依次增大, A元素阳离子的原子核外没有电子,B是空气中含量最多的元素;C元素原子最外层电子数是其电子层数的三倍;C与D可形成两种常见的离子化合物;工业上常用电解C与E的化合物来制备E单质。
(1)写出D元素的基态原子电子排布式。C、D、E的简单离子半径由小到大的顺序(用离子符号表示)。
(2)工业上常用A和B的单质合成一种常见气体,该气体的电子式。
检验该气体的常用方法是。
(3)D2C2与H2O反应的化学方程式是,D2C2与CuSO4溶液反应的现象是。
(4)A、B、C三种元素可组成一种常见离子化合物,其水溶液呈酸性,该溶液中离子浓度由大到小的顺序是。
(5)电动汽车的某种燃料电池,通常用NaOH作电解质,用E单质、石墨作电极,在石墨电极一侧通入空气,该电池的正极反应:。