乙醇分子中不同的化学键如下图所示,对乙醇在各种反应中应断裂的键说明不正确的是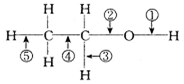
| A.和金属钠作用时,键①断裂 |
| B.和浓H2SO4共热至170℃时,键②和⑤断裂 |
| C.在Ag催化剂下和O2反应时,键①和③断裂 |
| D.和CH2COOH共热时,键②断裂 |
天然产物水有关解的叙述不正确的是()
| A.油脂水解可得到丙三醇 |
| B.可用碘检验淀粉是否发生水解 |
| C.蛋白质水解的最终产物均为氨基酸 |
| D.纤维素水解与淀粉水解得到的最终产物相同 |
叶酸是维生素B族之一,可以由下列甲、乙、丙三种物质合成:
下列关于甲、乙、丙的说法正确的是()
| A.甲的核磁共振氢谱图有4个峰,且峰的面积之比为2:2:2:1 |
| B.乙属于芳香族化合物 |
| C.1mol丙与足量的NaOH溶液或足量Na2CO3溶液充分反应,消耗的NaOH和Na2CO3的物质的量一定不相等 |
| D.丙的系统命名法为1-氨基-1,3-戊二酸 |
下列基团:-CH3、-C6H5(苯基)、-OH 、-CHO、-COOH两两组合(包含两种相同基团的组合)的有机物中,具有酸性的是()
| A.5种 | B.6种 | C.7种 | D.8种 |
下列各组有机物,不论按何种比例混合,只要总质量一定,完全燃烧生成水的总质量就相同的是()
| A.甲烷、丙烷 | B.甲苯、甘油 | C.甲酸、乙酸 | D.乙醇、乙二醇 |
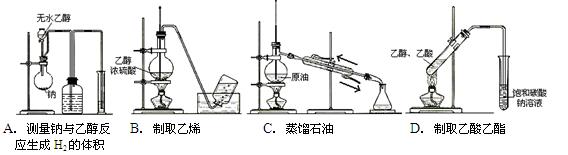
下列实验装置图完全正确的是()