在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:下列说法正确的是
(已知N2(g)+3H2(g) 2NH3(g)
2NH3(g)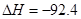 kJ·mol
kJ·mol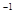 )
)
| 容器 |
甲 |
乙 |
丙 |
| 反应物投入量 |
1mol N2、3mol H2 |
2mol NH3 |
4mol NH3 |
NH3的平衡浓度(mol·L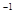 ) ) |
c1 |
c2 |
c3 |
| 反应的能量变化 |
放出akJ |
吸收bkJ |
吸收ckJ |
| 体系压强(Pa) |
p1 |
p2 |
p3 |
| 反应物转化率 |
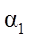 |
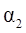 |
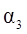 |
A.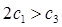 B.a+b>92.4 C.
B.a+b>92.4 C.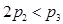 D.
D.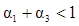
25℃、101 kPa下,2g氢气燃烧生成液态水,放出285.8kJ热量,表示该反应的热化学方程式正确的是()
A.2H2(g)+O2(g) ="=" 2H2O(1)△H= ―285.8kJ/mol |
| B.2H2(g)+O2(g) ="=" 2H2O(1)△H= +571.6 kJ/mol |
| C.2H2(g)+O2(g) ="=" 2H2O(g)△H= ―571.6 kJ/mol |
| D.H2(g)+1/2O2(g) ="=" H2O(1)△H= ―285.8kJ/mol |
已知:CH4(g)+2O2(g)==CO2(g)+2H2O(1) △H1 = ―Q1 KJ/mol
2H2(g)+O2(g)==2H2O(g) △H2= ―Q2 KJ/mol
2H2(g)+O2(g)==2H2O(1) △H3 = ―Q3KJ/mol
常温下,取体积比为4:1的甲烷和氢气的混合气体11.2L(已折合成标准状况),经完全燃烧后恢复至常温,则下列说法正确的是()
| A.放出的热量为(0.4Q1+0.05Q3)KJ | B.放出的热量为(0.4Q1+0.05Q2)KJ |
| C.△H2 = △H3 | D.△H2 <△H3 |
根据所学化学知识,判断施用钾肥草木灰(主要成份是K2CO3)时,不能和下列化肥混合使用的是( )
| A.NH4HCO3 | B.KCl | C.CO(NH2)2 | D.KNO3 |
未来氢气将作为新能源的优点的是()
①燃烧时发生氧化反应②充分燃烧的产物不污染环境
③氢气是一种再生能源④燃烧时放出大量热量
| A.①②③ | B.①②④ | C.①③④ | D.②③④ |
下列四种X溶液,均能跟盐酸反应,其中反应最快的是
| A.10℃ 20mL 3mol/L的X溶液 | B.20℃ 30mL 2molL的X溶液 |
| C.20℃10mL 4mol/L的X溶液 | D.10℃ 10mL 2mol/L的X溶液 |