下列离子方程式正确的是
| A.澄清的石灰水与稀盐酸反应Ca(OH)2 + 2H+=== Ca2+ + 2H2O |
| B.钠与水的反应Na + 2H2O === Na+ +2OH -+ H2 ↑ |
| C.硫酸氢钠溶液与少量氢氧化钡溶液混合:2H+ + SO42-+ Ba2+ + 2OH-=== BaSO4↓ + 2H2O |
D.向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O Fe(OH)3↓+3H+ Fe(OH)3↓+3H+ |
下列反应原理不符合工业冶炼金属实际情况的是
A.2HgO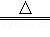 2Hg+O2↑ 2Hg+O2↑ |
B.2NaCl(熔融) 2Na+Cl2↑ 2Na+Cl2↑ |
C.2MgO(熔融)  2Mg+O2↑ 2Mg+O2↑ |
D.Fe2O3+3CO 2Fe+3CO2 2Fe+3CO2 |
对于4℃时,水中溶解了22.4L HCl气体(标准状况下测得)后形成的溶液200mL,下列说法中正确的是
| A.该溶液物质的量浓度为10mol/L |
| B.所用水的体积为177.6L |
| C.根据题干数据,该溶液物质的量浓度无法求得 |
| D.该溶液中溶质的质量分数因溶液的密度未知而无法求得 |
我国科学家在世界上第一次为一种名为“钴酞菁”的分子(直径为1.3纳米)恢复了磁性,“钴酞菁”分子结构和性质与人体的血红素及植物体内的叶绿素非常相似.下列关于“钴酞菁”分子的说法中正确的是
| A.在水中所形成的分散系属悬浊液 |
| B.分子直径比Na+小 |
| C.在水中形成的分散系能产生丁达尔效应 |
| D.“钴酞菁”分子不能透过滤纸 |
下列试剂的保存或使用正确的是
| A.实验室的氯水需要保存在棕色试剂瓶中 |
| B.漂白粉比氯水稳定,可露置在空气中 |
| C.称量氢氧化钠固体时,可在天平两个托盘上各放一张等质量的纸,左边纸上放NaOH,右边纸上放砝码 |
| D.金属钠可保存在煤油、四氯化碳等有机溶剂中 |
下表中关于物质分类的正确组合是
| 类别组合 |
酸性氧化物 |
碱性氧化物 |
酸 |
碱 |
盐 |
| A |
NO2 |
CuO |
H2SO4 |
NH3•H2O |
Na2S |
| B |
CO2 |
Na2O |
CH3COOH |
NaOH |
NaHCO3 |
| C |
SO2 |
Al2O3 |
HCl |
KOH |
NaCl |
| D |
SO3 |
CaO |
HNO3 |
Na2CO3 |
CaCO3 |
A. AB. BC. C D. D