利用如图所示装置进行下列实验,能得出相应实验结论的是
| 选项 |
① |
② |
③ |
实验结论 |
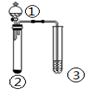 |
| A. |
稀盐酸 |
Na2S |
漂粉精溶液 |
酸性:盐酸>氢硫酸>次氯酸 |
|
| B. |
浓盐酸 |
KMnO4 |
Na2S溶液 |
氧化性:KMnO4> Cl2>S |
|
| C. |
浓氨水 |
NaOH |
酚酞 |
碱性:NaOH >NH3·H2O |
|
| D. |
浓硫酸 |
Na2SO3 |
BaCl2溶液 |
SO2与可溶性钡盐均不反应 |
化学与科学、技术、社会和环境密切相关。下列说法正确的是( )
| A.化学平衡常数是指一定条件下的可逆反应,生成物浓度的幂之积与反应物浓度的幂之积的比值。 |
| B.已知4HCl(g)+O2(g)=2H2O(g)+2Cl2(g) 能自发进行,则该反应ΔH<0,ΔS>0 |
| C.其他条件不变,增大压强,平衡可能移动,但平衡常数一定不变 |
| D.铁制品表面镶锌块和铁制品表面镀锡,都能起到防腐的作用且防腐原理是相同的 |
一容器中X元素构成的气态单质X2分子有3种,相对分子质量分别为32、34、36。又知容器中3种分子数之比为15∶4∶1。由此可以确定的是()
| A.若容器中X2全部转化为它的同素异形体X3,那么X3的分子量有3种 |
| B.质量数为16的一种核素在此容器中的原子百分数为85% |
| C.只要容器中同位素组成不变,X原子在任何条件下发生重新组合,最后得到三种 X2,分子数之比总是15∶4∶1 |
| D.此容器中X2的平均分子量是34 |
下列叙述正确的是
| A.电解饱和食盐水制烧碱采用离子交换膜法,可以阻止阳离子通过 |
| B.在铁上镀锌时,锌棒作阴极,且电解液硫酸锌的浓度是不变的 |
| C.用惰性电极电解Na2SO4溶液,阴阳两极产物的物质的量之比为1: 2 |
| D.用惰性电极电解饱和NaCl溶液,若有1 mol电子转移,则生成1 molNaOH |
下列叙述的方法不正确的是 ()
| A.金属的电化学腐蚀比化学腐蚀更普遍 |
| B.用铝质铆钉铆接铁板,铁板易被腐蚀 |
| C.钢铁在干燥空气中不易被腐蚀 |
| D.用牺牲锌块的方法来保护船身 |
室温下,将1mol的CuSO4·5H2O(s)溶于水会使溶液温度降低,热效应为ΔH1,将1mol的CuSO4(s)溶于水会使溶液温度升高,热效应为ΔH2,CuSO4·5H2O受热分解的化学方程式为:CuSO4·5H2O(s) CuSO4(s)+5H2O(1),热效应为ΔH3。则下列判断正确的是( )
CuSO4(s)+5H2O(1),热效应为ΔH3。则下列判断正确的是( )
| A.ΔH2>ΔH3 | B.ΔH1<ΔH3 | C.ΔH1+ΔH3=ΔH2 | D.ΔH1+ΔH2=ΔH3 |