在有机化合物中,若一个碳原子连有4个不同的原子或原子团,则这个碳原子称为“手性碳原子”。下列物质中没有“手性碳原子”的物质是
A.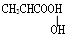 |
B.氨基乙酸 | C.α-氨基丙酸 | D.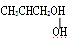 |
下列实验操作中,正确的是
①用托盘天平称取5.2 g NaCl;②用50 mL量筒量取5.2mL盐酸;③用蒸发皿加热NaCl溶液可以得到NaCl晶体;④用 100 mL容量瓶配制50 mL 0.1mol·L-1H2SO4溶液;⑤用带玻璃塞的棕色试剂瓶存放浓HNO3; ⑥中和热测定的实验中使用的玻璃仪器只有2种
| A.①③⑤ | B.②④⑥ | C.①③④ | D.③⑤⑥ |
物质的颗粒达到纳米级时,具有特殊的性质。如将单质铜制成“纳米铜”时,“纳米铜”具有非常强的化学活性,在空气中可以燃烧。下列叙述中正确的是
| A.常温下,“纳米铜”比铜片的金属性强 | B.常温下,“纳米铜”比铜片更易失电子 |
| C.常温下,“纳米铜”与铜片的还原性相同 | D.常温下,“纳米铜”比铜片的氧化性强 |
2002年由德、法、美及波兰等多国科学家组成的科研小组合成了非常罕见的 Fe原子,有关
Fe原子,有关 Fe的说法正确的是
Fe的说法正确的是
| A.它是一种新元素 | B. Fe与 Fe与 Fe互为同素异形体 Fe互为同素异形体 |
| C.它是一种新核素 | D.这种铁原子发生衰变放出两个质子后变成 Fe Fe |
将AsO +2I-+2H+=AsO
+2I-+2H+=AsO +I2+H2O设计成右下图所示的电化学装,其中C1、C2均为碳棒。甲、乙两组同学分别进行下述操作:
+I2+H2O设计成右下图所示的电化学装,其中C1、C2均为碳棒。甲、乙两组同学分别进行下述操作:
甲组:向B烧杯中逐滴加入浓盐酸乙组:向B烧杯中逐置滴加入40%NaOH溶液
下列描述中,正确的是
| A.甲组操作过程中,C2做负极 |
| B.乙组操作过程中,C1上发生的电极反应为: 2I—-2e—=I2 |
| C.两次操作过程中,微安表(G)指针的偏转方向相反 |
| D.甲组操作时该装置为原电池,乙组操作时该装置为电解池 |
有Fe2+、NO3-、Fe3+、NH4+、H+和H2O六种粒子,分别属于同一氧化还原反应中的反应物和生成物,下列叙述正确的是
| A.还原剂与氧化剂的物质的量之比为1︰8 |
| B.若把该反应设计为原电池,则负极反应为Fe2+-e-=Fe3+ |
| C.若有lmolNO3-发生氧化反应,则转移8mole- |
| D.该过程说明Fe( NO3)2溶液不宜加酸酸化 |