一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示,请回答下列问题:
(1)反应的化学方程式。
(2)反应开始到10s,用X表示的反应速率为多少?
(3)Y的平衡转化率。
(10分)现有可逆反应:2A(g)+3B(g) nC(g)+4D(g),起始时,将amol的A与bmol的B充入固定容积的密闭容器中,在一定条件下达平衡,测得A、B的转化率相等。
nC(g)+4D(g),起始时,将amol的A与bmol的B充入固定容积的密闭容器中,在一定条件下达平衡,测得A、B的转化率相等。
(1)则a:b=。
(2)若起始时在2L的密闭容器中充入4mol的A与12mol的B,在一定条件下发生上述可逆反应,经5min后达平衡,测得物质A的转化率为: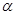 (A)=50%,测得平衡混合气体总物质的量为17mol。
(A)=50%,测得平衡混合气体总物质的量为17mol。
①则上述可逆反应中,n=。
②B的转化率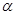 (B)=。
(B)=。
③在5min内,用物质D表示的平均反应速率是。
恒温下,将a mol N2与b mol H2的混合气体通入一个固定容积的密闭容器中,发生如下反应 :N2 (g) + 3 H2(g)  2NH3(g)
2NH3(g)若反应某时刻t时,n t (N2) =" 13" mol,n t (NH3) =" 6" mol,则a =__________mol;
反应达平衡时,混合气体的体积为716.8 L(标况下),其中NH3的含量(体积分数)为25%,平衡时NH3的物质的量__________;[
原混合气体与平衡混合气体的总物质的量之比(写出最简整数比、下同),n(始)∶n(平) =________;
原混合气体中,a∶b =__________;
达到平衡时,N2和H2的转化率之比,α(N2)∶α(H2)= __________;
平衡混合气体中,n(N2)∶n(H2)∶n(NH3) =__________________。
0.2mol有机物与1.6molO2在密闭容器中恰好完全反应后的产物为CO2和H2O(g),产物先通过足量的浓H2SO4质量增加21.6g,再通过碱石灰被完全吸收,质量增加44g。试推断该有机物的分子式(要求写出过程)
写出该有机物可能有的同分异构体的结构简式,并用系统命名法命名
将气体A、B置于容积为5L的密闭容器中,发生如下反应:3A(g) +B(g)  2C(g)+2D(g),反应进行到10s末,测得A的物质的量为1.8mol,B的物质的量为0.6mol,C的物质的量为0.8mol,则:
2C(g)+2D(g),反应进行到10s末,测得A的物质的量为1.8mol,B的物质的量为0.6mol,C的物质的量为0.8mol,则:
(1)求用C来表示的该反应的速率;
(2)求反应前A的物质的量浓度;
(3)反应10s后,求B物质的转化率。
(请在答题纸上写出本题详细的解题过程)
有一硫酸和硝酸的混合溶液,取出其中的10mL,加入足量 BaCl2溶液,将生成的沉淀滤出洗净,烘干称得其质量为9.32g;另取此溶液10mL与4.00 mol·L-1的NaOH溶液25mL恰好完全中和。求:
①混合液中硫酸的物质的量浓度是多少?
②混合液中硝酸的物质的量浓度又是多少?
③若将9.6g铜片投入到10mL的混合溶液中,则标况下能生成气体多少毫升?