利用海水制备部分物质的流程图如下。下列有关说法正确的是[
| A.电解熔融氯化镁制备镁,副产物氯气可以用于制盐酸,循环利用 |
| B.联合制碱法最终副产物为氯化铵,原子利用率小于100% |
| C.步骤②的操作是:在空气中加热氯化镁晶体得到无水氯化镁 |
| D.海水中离子的浓度较小,上述流程图只涉及溴元素的富集过程 |
列除去杂质的方法正确的是
| 物质 (杂质) |
除 杂 方 法 |
|
| A |
Cl2(HCl) |
将气体通过盛有氢氧化钠溶液的洗气瓶 |
| B |
CO2(HCl) |
将气体通过盛有饱和Na2CO3溶液的洗气瓶 |
| C |
氢氧化铁胶体(FeCl3) |
将混合物直接过滤 |
| D |
SiO2(CaCO3) |
加入盐酸后过滤 |
a、b、c、d均为短周期元素,a的原子结构示意图为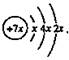 ,元素b的形成单质
,元素b的形成单质
|
可以与CO2发生置换反应,原子序数b<c<a,b与d形成的化合物电子式为
下列比较中正确的是
| A.原子半径c<d | B.呈得无素在同一周期 |
| C.气态氢化物的稳定性a<d | D.最高价氧化物对应的水化物的碱性b<c |
下列说法正确的是
①电解质溶液导电过程属于化学变化
②稀有气体不活泼的原因是它们原子的最外层都达到8电子稳定结构
③FeC12、CuS、NO都不能通过化合反应来制取
④SiO2是制造光导纤维的材料
| A.②④ | B.①④ | C.①③④ | D.②③ |
查阅资料发现,金属钠不仅能跟氧气和水反应,还能跟多种其它物质发生反应,其中包括与酒精在常温下反应。要研究金属钠跟酒精反应的性质以及它与水反应的异同 点,下列的研究方法中没有用到的是
| A.实验法 | B.观察法 | C.分类法 | D.比较法 |
已知:H2O(g)=H2O(l) △H1=-Q1 kJ/mol;
C2H5OH(g)=C2H5OH(l) △H2=-Q2 kJ/mol
C2H5OH(g)+3O2(g)=2CO2(g)+3 H2O(g) △H3=-Q3 kJ/mol
H2O(g) △H3=-Q3 kJ/mol
若使23g酒精液体完全燃烧,最后恢复到室温,则放出的热量是 多少kJ()
多少kJ()
| A.Q1+ Q2+Q3 | B.0.5(Q1+Q2+Q3) | C.0.5 Q2-0.5 Q3-1.5Q1 | D.1.5Q1-0.5Q2+0.5Q3 |