微型纽扣电池在现代生活中是广泛应用的一种银锌电池,其电极分别是Ag2O和Zn,电解质溶液为KOH溶液,电极反应式分别为:Zn+2OH--2e-===ZnO+H2O,Ag2O+H2O+2e-===2Ag+2OH-,电池总反应式为Ag2O+Zn===2Ag+ZnO。根据上述反应式,判断下列叙述中正确的是
| A.在使用过程中,电池负极区溶液pH增大 |
| B.在使用过程中,电子由Ag2O极经外电路流向Zn极 |
| C.在使用过程中,Zn电极发生还原反应,Ag2O电极发生氧化反应 |
| D.外电路中每通过0.2 mol电子,正极的质量理论上减小1.6 g |
常温下,一定浓度的某溶液,由水电离出的c(OH-)=10-4mol/L,则该溶液中的溶质可能是()
| A.Al2(SO4)3 | B.CH3COONa | C.NaOH | D.KHSO4 |
已知25℃时,Ksp[Cu(OH)2]=2×10-20
(1)某CuSO4溶液里c(Cu2+)=0.02 mol/L,如要生成Cu(OH)2沉淀,应调整溶液的pH,使之大于________。
(2)要使0.2 mol·L-1 CuSO4溶液中Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一),则应向溶液里加入NaOH溶液,使溶液的pH为________。
已知同温度下的溶解度:Zn(OH)2>ZnS,MgCO3>Mg(OH)2。就溶解或电离出S2-的能力而言,FeS>H2S>CuS,则下列离子方程式错误的是( )
A.Mg2++2HCO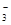 +2Ca2++4OH-===Mg(OH)2↓+2CaCO3↓+2H2O +2Ca2++4OH-===Mg(OH)2↓+2CaCO3↓+2H2O |
| B.Cu2++H2S===CuS↓+2H+ |
| C.Zn2++S2-+2H2O===Zn(OH)2↓+H2S↑ |
| D.FeS+2H+===Fe2++H2S↑ |
已知25℃时,Ka(HF)=3.6×10-4,Ksp(CaF2)=1.46×10-10。现向1 L 0.2 mol·L-1 HF溶液中加入1 L 0.2 mol·L-1 CaCl2溶液,则下列说法中,正确的是( )
| A.25℃时,0.1 mol·L-1 HF溶液中pH=1 |
| B.Ksp(CaF2)随温度和浓度的变化而变化 |
| C.该体系中没有沉淀产生 |
| D.该体系中HF与CaCl2反应产生沉淀 |
在100 mL 0.01 mol·L-1 KCl溶液中,加入1 mL 0.01 mol· L-1 AgNO3溶液,下列说法正确的是(已知AgCl的Ksp=1.8×10-10)( )
| A.有AgCl沉淀析出 | B.无AgCl沉淀析出 |
| C.无法确定 | D.有沉淀但不是AgCl |