以下是反应:2SO2+O2 2SO3在不同条件下达到平衡状态时SO2的转化率。
2SO3在不同条件下达到平衡状态时SO2的转化率。
试回答下列问题。
(1)关于可逆反应的限度,你能得出什么启示?______________________________。
(2)提高该化学反应限度的途径有:_____________________________________________。
(3)要实现SO2的转化率为93.5%,需控制的反应条件是_______________________________________。
(14分)以硫铁矿(主要成分为FeS2)为原料制取硫酸,其烧渣可用来炼铁。
(1)煅烧硫铁矿时发生反应:FeS2+O2―→Fe2O3+SO2(未配平)。当产生448 L(标准状况)SO2时,消耗O2的物质的量为____________。
(2)Fe2O3用CO还原焙烧的过程中,反应物、生成物和温度之间的关系如图所示。
(图中Ⅰ、Ⅱ、Ⅲ、Ⅳ四条曲线是四个化学反应平衡时的气相组成对温度作图得到的;A、B、C、D四个区域分别是Fe2O3、Fe3O4、FeO、Fe稳定存在的区域)
已知:3Fe2O3(s)+CO(g)===2Fe3O4(s)+CO2(g);ΔH1=a kJ·mol-1
Fe3O4(s)+CO(g)===3FeO(s)+CO2(g);ΔH2=b kJ·mol-1
FeO(s)+CO(g)===Fe(s)+CO2(g);ΔH3=c kJ·mol-1
① 反应Fe2O3(s)+3CO(g)===2Fe(s)+3CO2(g)的ΔH=____________kJ·mol-1(用含a、b、c的代数式表示)。
②800 ℃时,混合气体中CO2体积分数为40%时,Fe2O3用CO还原焙烧反应的化学方程式为__________________。
③ 据图分析,下列说法正确的是___________ (填字母)。
a. 温度低于570℃时,Fe2O3还原焙烧的产物中不含FeO
b. 温度越高,Fe2O3还原焙烧得到的固体物质组成中Fe元素的质量分数越高
c. Fe2O3还原焙烧过程中及时除去CO2有利于提高Fe的产率
(3) FeS2是Li/FeS2电池(示意图如图)的正极活性物质。
①FeSO4、Na2S2O3、S及H2O在200 ℃时以等物质的量连续反应24 h后得到FeS2。写出该反应的离子方程式: 。
②Li/FeS2电池的负极是金属Li,电解液是含锂盐的有机溶液。电池放电反应为FeS2+4Li===Fe+4Li++2S2-。该反应可认为分两步进行:第1步,FeS2+2Li===2Li++FeS22-,则第2步正极的电极反应式为____________________。
实验室用MnO2、KOH及KClO3为原料制取高锰酸钾的实验流程如下: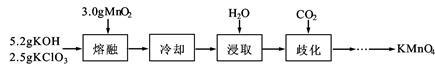
(1)熔融时需用铁坩埚和铁制搅拌棒而不能用玻璃仪器,其原因是 。
(2)熔融时,MnO2转化为K2MnO4,KClO3转化为KCl,其反应的化学方程式为 。
(3)几种物质的溶解度曲线如图所示。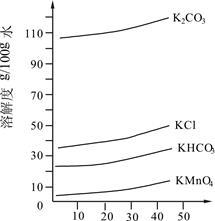
①歧化时,通入CO2至pH为10~11,K2MnO4绿色溶液转化为KMnO4和MnO2。其反应的离子方程式为 。
②歧化时不能通入过量CO2的原因是 。
③通入CO2后,用玻璃棒蘸取溶液点于滤纸上,观察到 ,证明歧化反应已发生。
④歧化后得到KMnO4晶体的操作依次为过滤、 、 及干燥。
(4)在此实验流程中可循环使用的物质的化学式为 。
(15分) 铝铁合金在微电机中有广泛应用,某兴趣小组为利用废弃的铝铁合金设计了如下实验流程制备聚合硫酸铁和明矾:
(1)聚合硫酸铁是一种无毒无害、化学性质稳定、能与水混溶的新型絮凝剂,微溶于乙醇,其化学式可表示为[Fe2(OH)x(SO4)y]n。
①聚合硫酸铁可用于净水的原理是 。
②有人认为上述流程中的“氧化”设计存在缺陷,请提出改进意见: ;浓缩时向其中加入一定量的乙醇,加入乙醇的目的是 。
③加入试剂Y的目的是调节pH,所加试剂Y为 ;溶液的pH对[Fe2(OH) x(SO4)y]n中x的值有较大影响(如图1所示),试分析pH过小(pH<3)导致聚合硫酸铁中x的值减小的原因: 。
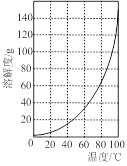
图1图2
(2)明矾是一种常见铝钾硫酸盐。
①为充分利用原料, 试剂X应为 。
②请结合图2所示的明矾溶解度曲线,补充完整由滤液Ⅰ制备明矾晶体的实验步骤(可选用的试剂:废弃的铝铁合金、稀硫酸、NaOH溶液和酒精):向滤液Ⅰ中加入足量的含铝废铁屑至不再有气泡产生, ,得到明矾晶体。
(12分)高氯酸钠可用于制备高氯酸。以精制盐水等为原料制备高氯酸钠晶体(NaClO4·H2O)的流程如下: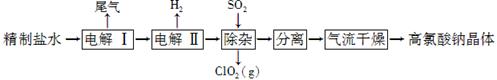
(1)由粗盐(含Ca2+、Mg2+、SO42-、Br-等杂质)制备精制盐水时需用到NaOH、BaCl2、Na2CO3等试剂。Na2CO3的作用是____________;除去盐水中的Br-可以节省电解过程中的电能,其原因是________________。
(2)“电解Ⅰ”的目的是制备NaClO3溶液,产生的尾气除H2外,还含有______________(填化学式)。“电解Ⅱ”的化学方程式为_____________________。
(3)“除杂”的目的是除去少量的NaClO3杂质,该反应的离子方程式为_______________________。“气流干燥”时,温度控制在80~100 ℃的原因是__________________。
(12分)利用铝灰(主要成分为Al、Al2O3、AlN、FeO等)制备铝鞣剂[主要成分为Al(OH)2Cl]的一种工艺如下: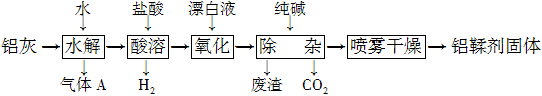
(1)气体A能使湿润的红色石蕊试纸变蓝。铝灰在90 ℃水解生成A的化学方程式为____________。“水解”采用90 ℃而不在室温下进行的原因是________________。
(2)“酸溶”时,Al2O3发生反应的离子方程式为 。
(3)“氧化”时,发生反应的离子方程式为 。
(4)“废渣”成分为______________(填化学式)。
(5)采用喷雾干燥而不用蒸发的原因是 。