对下列电解质溶液的叙述错误的是
| A.等物质的量浓度的Na2CO3和NaHCO3混合液中:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+) |
| B.25℃时,0.2 mol·L-1盐酸与等体积0. 05 mol.L-lBa(OH)2溶液混合后,溶液的pH=l |
| C.pH=3的二元弱酸H2R溶液与pH=11的NaOH溶液混合后,混合液的pH等于7,则反应后的混合液中:2c(R2-)+c(HR-)=c(Na+) |
| D.25℃时,若0.3 mol.L-1 HY溶液与0.3 mol.L-l NaOH溶液等体积混合后,溶液的 pH=9,则:c(OH-)一c(HY)=1×l0-9 mol.L-1 |
下列关于一部分单质和氧化物、酸、碱、盐分类的说法正确的是
①纯碱②硝酸铜③食盐④硝酸⑤盐酸⑥硫酸钠⑦硫酸⑧火碱⑨生石灰⑩氯气
| A.含氧酸盐有①②③⑥ |
| B.①和⑧是同一种物质 |
C.可以把⑥归类为: |
| D.不能把⑦和⑧归为一类物质 |
一定条件下存在反应:CO(g)+H2O(g) CO2(g)+H2(g),其正反应放热。现有三个相同的2L恒容绝热(与外界没有热量交换)密闭容器I、II、III,在I中充入1molCO和1molH2O,在II中充入1molCO2和1mol H2,在III中充入2molCO和2molH2O,700℃条件下开始反应。达到平衡时,下列说法正确的是
CO2(g)+H2(g),其正反应放热。现有三个相同的2L恒容绝热(与外界没有热量交换)密闭容器I、II、III,在I中充入1molCO和1molH2O,在II中充入1molCO2和1mol H2,在III中充入2molCO和2molH2O,700℃条件下开始反应。达到平衡时,下列说法正确的是
| A.容器I、II中正反应速率相同 |
| B.容器I、III中反应的平衡常数相同 |
| C.容器I中CO的物质的量比容器II中的少 |
| D.容器I中CO的转化率与容器II中CO2的转化率之和小于1 |
在密闭容器中,5 mol H2与2 mol CO2发生反应:3H2(g)+CO2(g) CH3OH(g)+H2O(g)。反应达到平衡时,改变温度(T)和压强(p),反应混合物中甲醇(CH3OH)的物质的量分数变化情况如下图所示。下列说法错误的是
CH3OH(g)+H2O(g)。反应达到平衡时,改变温度(T)和压强(p),反应混合物中甲醇(CH3OH)的物质的量分数变化情况如下图所示。下列说法错误的是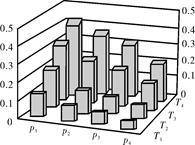
| A.P1>P2>P3>P4 |
| B.甲醇的物质的量分数越高,反应的平衡常数越大 |
| C.若T1> T2> T3>T4,则该反应为放热反应 |
| D.缩小容积,可以提高CH3OH在混合物中的质量分数 |
某实验小组以H2O2分解为例,探究浓度、催化剂、温度对反应速率的影响。按照如下方案完成实验。下列说法不正确的是
| 编号 |
反应物 |
催化剂 |
温度 |
| ① |
10mL10% H2O2溶液 |
无 |
25℃ |
| ② |
10mL20% H2O2溶液 |
无 |
25℃ |
| ③ |
10mL20% H2O2溶液 |
无 |
40℃ |
| ④ |
10mL20% H2O2溶液 |
1mL0.1mol/LFeCl3溶液 |
40℃ |
A.实验④反应速率最快
B.实验①反应速率最慢
C.实验②速率小于实验④的速率,只是因为实验④加入了催化剂
D.加入催化剂,能增大活化分子百分数,从而加快化学反应速率
用NaOH溶液滴定盐酸时,由于滴定速度太快,当混合溶液变红时不知NaOH是否过量,判断它是否过量的方法是
| A.加入5mL盐酸再进行滴定 | B.返滴一滴待测盐酸 |
| C.重新进行滴定 | D.以上方法均不适用 |