四种短周期元素X、Y、Z、W的原子序数依次增大,X的最外层电子数是次外层电子数的2倍,Y、W同主族且能形成两种常见的化合物,X、W质子数之和是Z质子数的2倍。则下列说法中正确 的是
| A.原子半径比较:X<Y<Z<W |
| B.X的氢化物沸点一定低于Y的氢化物 |
| C.Y的氢化物稳定性一定弱于W的氢化物 |
| D.短周期所有元素中,Z的最高价氧化物的水化物碱性最强 |
下列关于实验室制取气体所用试剂的组合不合理的是
| A.制Cl2:MnO2、盐酸(浓) | B.制H2:硫酸(稀)、Zn |
| C.制O2: MnO2、H2O2 | D.制CO2:硫酸(稀)、CaCO3 |
下列说法正确的是
| A.需要加热才能发生的反应一定是吸热反应 |
| B.任何放热反应在常温下一定能发生反应 |
| C.放热反应不需要加热就能发生 |
| D.吸热反应在一定条件(如常温、加热等)下也能发生 |
有人认为CH2=CH2与Br2的加成反应,实质是Br2先断裂为Br+和Br-,然后Br+首先与CH2=CH2一端碳原子结合,第二步才是Br一与另一端碳原子结合。根据该观点如果让CH2=CH2与Br2在盛有NaCl和NaI的水溶液中反应,则得到的有机物不可能是
| A.BrCH2CH2Br | B.BrCH2CH2I |
| C.ClCH2CH2Cl | D.BrCH2CH2Cl |
近几年一种新型的甜味剂“木糖醇”悄悄地走入人们的生活,木糖醇是一种理想的蔗糖代替品,它具有甜味足,溶解性好,防踽齿,适合糖尿病患者的优点。木糖醇是一种白色粉末状的结晶,结构简式为CH2OH(CHOH)3CH2OH,下列关于木糖醇的叙述中正确的是
| A.木糖醇不属于糖类 |
| B.木糖醇能跟新制的氢氧化铜浊液反应生成砖红色沉淀 |
| C.它与葡萄糖互为同分异构体 |
| D.可以与乙酸在一定条件下发生酯化反应 |
对于可逆反应:H2(g)+I 2(g) 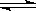 2HI(g),在温度一定下,从正方向开始发生反应,下列说法正确的是
2HI(g),在温度一定下,从正方向开始发生反应,下列说法正确的是
| A.H2的消耗速率与HI的生成速率之比为2:1 |
| B.反应进行的净速率是此时正、逆反应速率之差 |
| C.正、逆反应速率的比值是恒定的 |
| D.达到平衡时,正、逆反应速率相等 |