某校课外活动小组的同学在老师的帮助下,探究用赤铁矿(主要成分是Fe2O3)炼铁的主要反应原理.他们设计的实验装置如图所示.回答下列问题:
(1)先检查装置的气密性;实验开始应检验________________________________,以防止爆炸.
(2)实验时,在澄清石灰水中观察到的现象是________________________________.
(3)图甲中,设计第②个酒精灯的目的是________________________,实验时应先点燃第________个酒精灯;实验结束时应先停止________处的酒精灯加热.
(4)图乙与图甲相比,它的主要优点是________________________________.
(5)在反应后可将磁铁悬挂在玻璃管上方,其作用是________________________________.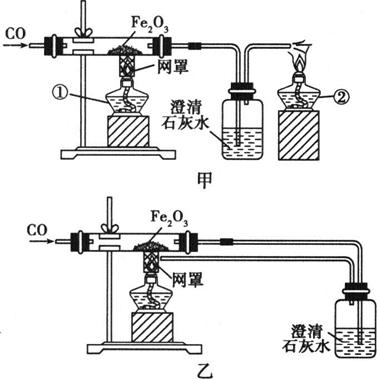
甲、乙试管中各盛有10.0g水,向其中一支试管中加入3.0gNa 2CO 3粉末,另一支试管中加入3.0g NaCl粉末,按图1、2进行实验,下列说法正确的是( )

| A. |
甲中加入的粉末是Na 2CO 3 |
| B. |
0℃时,甲中溶液一定不饱和,乙中溶液一定饱和 |
| C. |
Na 2CO 3中含有少量NaCl,可用冷却热饱和溶液的方法提纯Na 2CO 3 |
| D. |
30℃时,若使图1中甲、乙试管内的溶液恰好变为相应饱和溶液,甲中加入对应的溶质质量大于乙中加入对应的溶质质量 |
下列说法正确的是( )
| A. |
原子通过得失电子形成离子,离子一定不能形成原子 |
| B. |
不饱和溶液转化为饱和溶液,溶质的质量分数一定增大 |
| C. |
中和反应生成盐和水,有盐和水生成的反应一定是中和反应 |
| D. |
某溶液中滴入无色酚酞试液后变红,该溶液一定是碱性溶液 |
有Cu 2(OH) 2CO 3[M r=222]与Cu的混合物25.4g,在空气中加热一段时间,得剩余固体23.1g,向该固体中加入300.0g 9.8%的稀硫酸,固体完全溶解,测得反应过程中实际消耗9.8%的稀硫酸250.0g。下列说法正确的是( )
| A. |
剩余固体为纯净物 |
| B. |
上述加热过程中共生成H 2O和CO 2的质量为2.3g |
| C. |
原混合物中Cu 2(OH) 2CO 3与Cu的质量比为111:16 |
| D. |
最终所得溶液的质量为318.7g |
下列实验操作中不能达到实验目的是( )
|
选项 |
物质 |
目的 |
主要实验操作 |
|
A |
CO 2和SO 2 |
鉴别 |
分别通入稀KMnO 4溶液,观察现象 |
|
B |
CaO中含有CaCO 3 |
检验 |
取样,加入足量稀盐酸,观察现象 |
|
C |
MnO 2和KCl的混合物 |
分离 |
溶解、过滤,洗涤固体并烘干,蒸发滤液 |
|
D |
BaCl 2溶液混有Ba(NO 3) 2杂质 |
除杂 |
先加入过量Na 2SO 4溶液,过滤、洗涤;再向所得固体中加入适量稀盐酸 |
| A. |
A |
B. |
B |
C. |
C |
D. |
D |
下列物质的转化在给定条件下均能实现的是( )
| A. |
H 2 |
| B. |
Ag |
| C. |
Ca(OH) 2溶液 |
| D. |
NaCl |