在不同温度下,水溶液中c(H+)与c(OH-)有如下图所示关系。下列关于离子共存说法中正确的是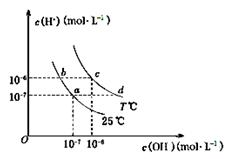
| A.a点对应的溶液中大量存在:Fe3+、Na+、Cl-、SO42— |
| B.b点对应的溶液中大量存在:NH4+、Ba2+、OH-、I- |
| C.c点对应的溶液中大量存在:Na+、Ba2+、Cl-、HCO3— |
| D.d点对应的溶液中大量存在:Na+、K+、SO32—、Cl- |
用NA表示阿伏加德罗常数的值。下列叙述中正确的是
| A.常温常压下42g 乙烯和丁烯混合气体中,极性键数为6NA |
| B.100 mL 0.1 mol·L-1 Na2CO3溶液中,离子总数是0.03NA |
| C.标准状况下,11.2L的O2和NO的混合物含有的分子数约为0.5×6.02×1023 |
| D.6.4g SO2与足量氧气反应生成SO3,转移电子数为0.2NA |
下列解释事实的化学方程式或离子方程式正确的是
| A.用食醋除去暖水瓶中的水垢:2CH3COOH+CaCO3===Ca2++2CH3COO-+CO2↑+H2O |
| B.碳酸氢铵溶液中加入足量氢氧化钡溶液: NH4++HCO3-+2OH-==CO32-+ NH3•H2O +H2O |
| C.Fe(NO3)3溶液中加入过量的HI溶液:2Fe3+ + 2I-= 2Fe 2+ + I2 |
D.Ca(HCO3)2溶液中加入少量的NaOH溶液: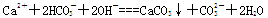 |
甲、乙、丙、丁为4种短周期元素,在周期表中,甲与乙、丙、丁在周期表中的位置关系如图所示(原子序数:乙>丙)。丁的原子序数与乙、丙原子序数之和相等,4种元素原子的最外层电子数之和为24。下列判断正确的是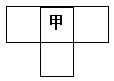
| 甲 |
||
A.元素甲的简单气态氢化物稳定性比乙的强
B.元素乙在周期表中的位置为第2周期,VIA族
C.元素丙和元素丁的最高价氧化物对应的水化物均为强酸
D.4种元素的简单阴离子半径从大到小顺序为:丁>乙>丙>甲
某离子反应中涉及H2O、ClO—、NH4+、H+、N2、Cl—六种微粒。其中N2的物质的量随时间变化的曲线如右图所示。下列判断正确的是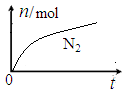
| A.该反应的还原剂是Cl— |
| B.消耗1 mol还原剂,转移6 mol电子 |
| C.氧化剂与还原剂的物质的量之比为2:3 |
| D.反应后溶液的酸性明显增强 |
对下列反应①KHCO3溶液与石灰水反应、②Na2SO3溶液与稀盐酸反应、③Si与烧碱溶液反应、④Fe与稀硝酸反应。改变反应物用量,不能用同一个离子方程式表示的是
| A.①②③ | B.①②④ | C.①③④ | D.②③④ |