短周期主族元素A、B、C、D、E的原子序数依次增大,其中A与C同主族,A与其它元素不在同一周期,B与D同主族,常温下D的单质为淡黄色固体.下列推断正确的是
A.原子半径由小到大的顺序:r(C)<r(D)<r(E)
B.元素D、E分别与A形成的化合物的热稳定性:E>D
C.元素D的最高价氧化物对应水化物的酸性比E的强
D.元素B分别与A、C形成的化合物中化学键的类型不同
下列实验操作、现象与结论对应关系正确的是
| 选项 |
实验操作 |
实验现象 |
结论 |
| A |
将苯滴入溴水中,振荡,静置 |
溴水层褪色 |
溴和苯发生加成反应 |
| B |
向溶液中加入盐酸 |
有白色沉淀生成, |
溶液中一定存在Ag+ |
| C |
在0.1mol·L-1CH3COONa溶液中,加两滴酚酞显浅红色,微热 |
红色加深 |
盐类水解是吸热反应 |
| D |
用玻璃棒蘸取浓氨水点到红色石蕊试纸上 |
试纸变蓝色 |
浓氨水呈碱性 |
常温下,向100 mL 0.01 mol·L-1HA溶液中逐滴加入0.02 mol·L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计)。下列说法中不正确的是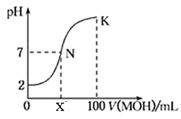
| A.HA一定为一元强酸 |
| B.若x>50,则MOH为一元弱碱 |
| C.N点溶液中:c(A-)=c(M+)>c(OH—)=c(H+) |
| D.若K点对应的溶液的pH=12,则K点溶液中水的电离程度大于0.01 mol·L-1HA溶液中水的电离程度 |
如图所示的电化学装置,下列叙述正确的是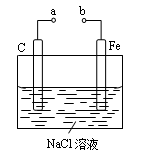
| A.a和b用导线连接,溶液中的Na+向铁电极移动 |
| B.a和b用导线连接,碳电极的电极反应为:O2+2H2O-4e-=4OH— |
| C.a、b分别连接直流电源正、负极,可以防止铁被腐蚀,属于牺牲阳极的阴极保护法 |
| D.若碳电极换成铜电极,氯化钠换成硫酸铜,a、b分别连接直流电源负、正极,可实现铁上镀铜 |
设NA为阿伏伽德罗常数的数值。下列说法正确的是
| A.78g苯中C—C和C=C的个数均是3NA |
| B.标准状况下,NA个SO3分子的体积约是22.4L |
| C.Na与氧气化合生成0.1molNa2O2转移0.4NA个电子 |
| D.常温下,1L 0.1mol·L—1的Na2S溶液中的阴离子数目大于0.1NA |
下列叙述Ⅰ和Ⅱ均正确并且有因果关系的是
| 选项 |
叙述Ⅰ |
叙述Ⅱ |
| A |
SO2有弱氧化性 |
SO2能使品红溶液褪色 |
| B |
SiO2能与氢氧化钠、氢氟酸反应 |
SiO2是酸性氧化物 |
| C |
碳酸钠能与酸反应 |
碳酸钠可作治疗胃酸过多的一种药剂 |
| D |
Ksp(CuS)、Ksp(HgS)均很小 |
可用Na2S除去废水中的Cu2+和Hg2+ |