某小组用下图装置进行实验,下列说法正确的是
| A.盐桥中的电解质可以用KC1 |
| B.闭合K,外电路电流方向为Fe电极→石墨电极 |
| C.闭合K,石墨电极上只生成铜 |
D.导线中流过0.15 mol 时,加入5.55 g Cu2(OH)2CO3, CuSO4溶液可恢复原组成 时,加入5.55 g Cu2(OH)2CO3, CuSO4溶液可恢复原组成 |
设NA为阿伏加德罗常数,下面叙述正确的是 ()
| A.标准状况下,11.2L SO3所含分子数为0.5 NA |
| B.1L 1mol/L的氯化钠溶液中,所含离子数为NA |
| C.常温下,4.4g CO2和N2O(不反应)混合物中所含有的原子数为0.3 NA |
| D.一定量的铜与足量的浓硫酸反应,放出2.24L气体时,转移电子数为0.2 NA |
下列物质能将Fe3+转化为Fe2+的有()
①新制氯水②铁③铜④稀硫酸
| A.①②③ | B.③④ | C.②③ | D.①②③④ |
下列离子方程式正确的是()
| A.澄清石灰水中滴加稀硫酸:Ca(OH)2+2H+====Ca2++2H2O |
| B.实验室用氨水制备少量Al(OH)3:Al3++ 3OH-====Al(OH)3↓ |
| C.向FeBr2溶液中通入过量氯气:2Fe2++Cl2====2Fe3++2Cl- |
| D.向NaOH溶液中滴加同浓度的少量Ca(HCO3)2溶液: |
Ca2++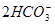 +2OH-====CaCO3↓+
+2OH-====CaCO3↓+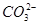 +2H2O
+2H2O
在溶液中加入过量Na2O2后仍能大量共存的离子组是( )
| A.NH4+、Ba2+、Cl-、NO3- | B.K+、AlO2-、Cl-、SO42- |
| C.Ca2+、Mg2+、NO3-、HCO3- | D.Na+、Cl-、CO32-、SO32- |
某元素的一种同位素X的原子质量数为A,含N个中子,它与11H原子组成HmX
分子,在agHmX中所含质子的物质的量是()
A.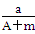 (A-N+m)mol (A-N+m)mol |
B.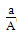 (A-N)mol (A-N)mol |
C.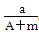 (A-N)mol (A-N)mol |
D.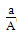 (A-N+m)mol (A-N+m)mol |