pH=1的某溶液X中仅含有NH4+、Al3+、Ba2+、Fe2+、Fe3+、CO32-、SO32-、SO42-、Cl-、NO3-中的一种或几种(忽略水的电离及离子的水解),取该溶液进行连续实验,实验过程如下:
下列有关推断不正确的是
| A.沉淀H为Al(OH)3、BaCO3的混合物 |
| B.根据上述连续实验不能确定溶液X中是否含有Fe3+、Cl- |
| C.溶液X中一定含有Al3+、NH4+、Fe2+、SO42-、H+ |
| D.若溶液X为100 mL,产生的气体A为44.8 mL(标况),则X中c(Fe2+)="0.06" mol·L-1 |
化学反应伴随能量变化,下列说法中错误的是
| A.TNT(炸药)爆炸时部分化学能转化为热能 |
| B.电解饱和食盐水时部分化学能转化为电能 |
| C.镁条燃烧时部分化学能转化为光能 |
| D.植物光合作用时部分光能转化为化学能 |
以下分离提纯操作能达到相应目的的是
| 选项 |
操作 |
目的 |
| A |
电解精炼 |
将粗铜转化为精铜 |
| B |
蒸馏 |
分离氯化钠和硝酸钾混合溶液 |
| C |
分液 |
分离乙酸与乙酸乙酯混合物 |
| D |
用乙醇作萃取剂 |
提取溴水中的溴单质 |
碘元素的一种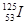 核素可用于治疗肿瘤。下列有关碘元素的说法正确的是
核素可用于治疗肿瘤。下列有关碘元素的说法正确的是
A.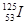 核外有72个电子 核外有72个电子 |
B.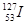 与 与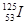 互为同素异形体 互为同素异形体 |
C.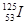 能使淀粉溶液变蓝 能使淀粉溶液变蓝 |
D.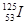 最外层电子数为7 最外层电子数为7 |
常温时能与水反应产生H2的是
| A.Na | B.NH4Cl | C.Na2O2 | D.NO2 |
共价键、离子键和分子间作用力是构成物质的微粒间的不同作用方式,下列物质中只存在上述一种作用方式的是
| A.二氧化碳 | B.氢氧化钠固体 | C.NaCl晶体 | D.氯气 |