【化学——选修3:物质结构与性质】(15分)稀土元素是指元素周期表中原子序数为57到71的15种镧系元素,以及与镧系元素化学性质相似的钪(Sc)和钇(Y)共17 种元素。稀土有“工业维生素”的美称,如今已成为极其重要的战略资源。
(1)钪(Sc)为21号元素,其基态原子M能层电子数为 。镝(Dy)的基态原子电子排布式为[Xe]4f106s2,一个基态镝原子所含的未成对电子数为 。
(2)稀土元素最常见的化合价为+3价,但也有少数还有+4价。请根据下表中的电离能数据判断表中最有可能有+4价的元素是 。
几种稀土元素的电离能(单位:kJ·mol-1)
| 元素 |
I1 |
I2 |
I3 |
I1+I2+I3 |
I4 |
| Sc(钪) |
633 |
1235 |
2389 |
4257 |
7019 |
| Y(钇) |
616 |
1181 |
1980 |
3777 |
5963 |
| La(镧) |
538 |
1067 |
1850 |
3455 |
4819 |
| Ce(铈) |
527 |
1047 |
1949 |
3523 |
3547 |
(3)离子化合物 Na3[Sc(OH)6]中,存在的作用力除离子键外还有 。
(4)Sm(钐)的单质与1,2-二碘乙烷可发生如下反应:Sm+ICH2CH2I→SmI2+CH2=CH2。
ICH2CH2I中碳原子杂化轨道类型为 ,1 mol CH2=CH2中含有的σ键数目为 。常温下1,2-二碘乙烷为液体而乙烷为气体,其主要原因是 。
(5)PrO2(二氧化镨)的晶体结构与CaF2相似,晶胞中Pr(镨)原子位于面心和顶点。则PrO2(二氧化镨)的晶胞中有 个氧原子。
(6)Ce(铈)单质为面心立方晶体,其胞参数为a=516pm。晶胞中Ce(铈)原子的配位数为 ,列式表示Ce(铈)单质的密度: g·cm-3(不必计算出结果)。
(3分)有机合成材料的出现是材料发展史上的一次重大突破。现代以石油化工为基础的三大
合成材料是、、。
已知水在25℃和95℃时,其电离平衡曲线如右图所示:
(1)则25 时水的电离平衡曲线应为
(2)25时,将=9的NaOH溶液与=4的溶液混合,若所得混合溶液的=7,则NaOH溶液与溶液的体积比为
(3)95时,若100体积1=的某强酸溶液与1体积2=b的某强碱溶液混合后溶液呈中性,则混合前与b之间应满足的关系是
常温下,将0.01mol NH4Cl和0.002mol NaOH溶于水配成1L混合溶液,
(1)该溶液中存在的电离平衡是______________________________________和________________________________,水解反应为_________________________。(用方程式表示)
(2)溶液中c( Na+ )=、c( Cl—)=
(3)c ( NH4+) 0.01mol/L(填 > 、 < 或=)
(4)写出溶液中电荷守恒的等式______________________________________。
在稀氨水中存在下述电离平衡NH3 + H2O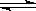 NH3 ·H2O
NH3 ·H2O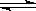 NH4+ + OH—,分别加入少量下列物质,溶液中c ( OH—) 如何变化?(填
NH4+ + OH—,分别加入少量下列物质,溶液中c ( OH—) 如何变化?(填 “增大”“减小”或“不变”);平衡移动方向如何(填“正向”或“逆向”)?
“增大”“减小”或“不变”);平衡移动方向如何(填“正向”或“逆向”)?
加入 的物质 的物质 |
少量(NH4)2SO4固体 |
少量HNO3溶液 |
少量KOH溶液 |
| c( OH—)的变化 |
|||
| 平衡移动方向 |
0.1mol/L的下列溶液, pH由小到大排列顺序为(填编号);实验室配制⑤的溶液时常需加入少量盐酸,否则得到的是混浊的溶液,产生混浊的原因是(用离子方程式表示):。
①HCl、②CH3COOH、③CH3COONa、④NaOH、⑤FeCl3、⑥NaCl 。