【化学—选修3物质结构与性质】已知:碳、氮、氢、氧四种元素可形成多种化合物,且有非常重要的用途。
(1)C、N、H电负性的大小顺序为 。
(2)甲烷与二氧化氮可发生如下反应:CH4(g)+2NO2(g)=CO2(g)+N2(g)+2H2O(g) ,若反应中有2mol C-H键断裂,则形成的π键共有 mol。
(3)F2与NH3在一定条件下可形成NF3,NF3分子的空间构型为 形 。
(4)现已合成出一种硬度比金刚石还大的晶体氮化碳,其化学式为 。其硬度比金刚石大的主要原因是 。
(5)配合物Y的结构如图所示,Y中含有 (填序号)。
A.非极性共价键
B.配位键
C.极性键
D.氢键
E.金属键
Y中碳原子的杂化方式有 。
写出镍(Ni)原子的价电子排布式 。
(6)氨气与铁在一定条件下发生置换反应,一种产物的晶胞结构如下图所示,若该立方体晶胞的棱长为a pm,则该晶体的密度为 g/cm3(NA为阿佛加德罗常数的值)。
(1)在Fe(OH)3胶体中逐滴加入HI稀溶液,会出现一系列变化:
①先出现红褐色沉淀,原因是:;
②随后沉淀溶解,溶液呈黄色,写出此过程反应的离子方程式:;
③最后溶液颜色加深,原因是:,此过程的离子方程式是:;④如用稀盐酸代替HI稀溶液,能出现上述哪些相同的实验现象:(写序号)。
(2)2.00gC2H2气体完全燃烧生成液态水和CO2气体,放出99.6kJ的热量,写出该反应燃烧的热化学反应方程式;
已知反应①、②是化工生产中的两个重要反应
①甲溶液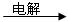 A + B + C
A + B + C
②乙经过粉碎后在沸腾炉中燃烧,得到D和E
其中,A、D在常温常压下为刺激性气味气体,C为无色无味气体。请回答:
(1)A的电子式是。
(2)将A通入B的溶液中,反应的离子方程式是。
(3)1 g C在A中燃烧时放出92.3 kJ的热量,该反应的热化学方程式是。
(4)工业上可利用E为原料冶炼其中所含的金属,方法是。
(5)化工生产②中第二步、第三步用到的设备名称分别为、。第二步采用的反应条件为。
(6)将A和D按物质的量1:1通入下列装置中:
该过程中的化学方程式是:_______________________。
上述实验装置设计不完整,请将所缺部分在装置图的右边方框中画出。
(7)一定条件下,将12 g乙放入过量的的浓硝酸中,反应过程中转移1.5 mol电子,该反应的离子方程式是。
在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子称为活化分子,使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ/mol表示。请认真观察下图,然后回答问题。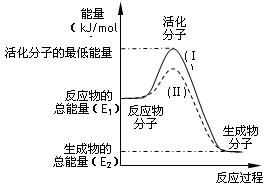
(1)图中所示反应是_________(填“吸热”或“放热”)反应,该反应________(填“需要”或“不需要”)加热,该反应的△H=___________________kJ/mol(用含E1、E2的代数式表示)
(2)已知热化学方程式:H2(g)+ 0.5 O2(g)=H2O(g);△H=-241.8 kJ/mol
该反应的活化能为167.2 kJ/mol,则其逆反应的活化能为____________________。
(3)对于同一反应,图中虚线(Ⅱ)与实线(Ⅰ)相比,活化能大大降低,活化分子的百分数增多,反应速率加快,你认为最可能的原因是:___________________________。
A、B、C、D、E都是元素周期表中前20号元素,其原子序数依次增大。B、C、D同周期,A、D同主族,E和其它元素既不在同周期也不在同主族。B、C、D的最高价氧化物的水化物均能互相反应生成盐和水。A和E可形成离子化合物,其晶胞结构如下图所示: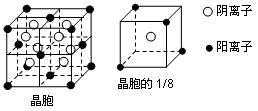
(1)A和E所形成的化合物的电子式是
(2)A、B、C、D四种元素的原子半径由小到大的顺序为(用元素符号表示)
(3)A和D的氢化物中,后者沸点较低,原因是____________
(4)A和E的化合物晶体中,每个阳离子的周围与它最近且等距离的阳离子共有个
(5)已知A和E所形成的化合物晶体的晶胞体积为1.6×10-22cm3,则A和E组成的离子化合物的密度为(结果保留一位小数)。
(1) 电池反应通常是放热反应,下列反应在理论上可设计成原电池的化学反应是
(填序号)。此类反应具备的条件是①反应,②反应。
| A.C(s)+H2O(g)==CO(g)+H2(g):△H>0 |
| B.Ba(OH)2·8H2O(s)+2NH4Cl(s)==BaCl2(aq)+2NH3·H2O(l)+8H2O(l)△H>0 |
| C.CaC2(s)+2 H2O(l)==Ca(OH)2(s)+C2H2(g);△H<0 |
| D.CH4(g)+2O2(g)==CO2(g)+2H2O(l):△H<0 |
(2) 以KOH溶液为电解质溶液,依据(I)所选反应设计一个电池。其负极反应为:。
(3) 电解原理在化学工业中有广泛的应用。现将你设计的原电池通过导线与图中电解池相连,其中a为电解液,X和Y是两块电极扳,则
①若X和Y均为惰性电极,a为饱和食盐水,则电解时检验Y电极反应产物的方法是。
②若X、Y分别为石墨和铁,a仍为饱和的NaCI溶液,则电解过程中生成的白色固体露置在空气中,可观察到的现象是。
③若X和Y均为惰性电极,a为一定浓度的硫酸铜溶液,通电后,发生的总反应化学方程式为。通电一段时间后,向所得溶液中加入0.05 mol Cu(OH)2,恰好恢复电解前的浓度和PH,则电解过程中电子转移的物质的量为____________mol.
(4)利用工业上离子交换膜法制烧碱的原理,用如图所示装置电解K2SO4溶液。
①该电解槽的阳极反应式为,通过阴离子交换膜的离子数(填“>”、“<”或“=”)通过阳离子交换膜的离子数;
②图中a、b、c、d分别表示有关溶液的pH,则a、b、c、d由小到大的顺序为;
③电解一段时间后,B口与C口产生气体的质量比为。