一种基于酸性燃料电池原理设计的酒精检测仪,电池反应的化学方程式为:
CH3CH2OH+O2=CH3COOH+H2O。下列有关说法不正确的是
| A.检测时,电解质溶液中的H+向正极移动 |
| B.若有0.4mol电子转移,则消耗2.24L氧气 |
| C.正极上发生还原反应,负极上发生氧化反应 |
| D.负极上的反应为:CH3CH2OH-4e-+H2O=CH3COOH+4H+ |
下列溶液中各微粒的浓度关系正确的是
| A.pH=4的盐酸中:c(H+)=4.0mol·L-1 |
| B.NH4Cl溶液中:c(Cl-)=c(NH4+) |
| C.NaCl溶液中:c(Na+) + c(H+)= c(Cl-)+c(OH-) |
| D.NaHCO3溶液中:c(HCO3-)+c(H2CO3)+ c(CO32-) =c(Na+) |
下列实验事实能用平衡移动原理解释的是
A.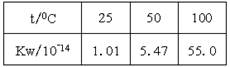 |
B. |
C.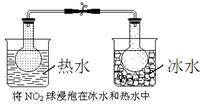 |
D.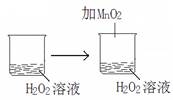 |
下列有关实验操作的说法正确的是
| A.用10mL量筒量取8.10mL稀盐酸 |
| B.用pH计测得某溶液的pH为2.3 |
| C.用pH试纸测定溶液的pH时,需先用蒸馏水润湿试纸 |
| D.可用25mL酸式滴定管量取20.00mL KMnO4溶液 |
下列表达式书写正确的是
| A.CaCO3的电离方程式:CaCO3=Ca2++CO32- |
B.HCO3-的电离方程式:HCO3-+H2O H3O++CO32- H3O++CO32- |
C.CO32-的水解方程式:CO32-+2H2O H2CO3+2OH- H2CO3+2OH- |
| D.CaCO3的沉淀溶解平衡表达式:CaCO3(s)=Ca2+(aq)+CO32-(aq) |
25℃时,某物质的溶液中,由水电离出的c(H+)=1×10-5mol·L-1,下列说法一定正确的是
| A.该溶液的溶质是碱 | B.该溶液显碱性 |
| C.该溶液的溶质是酸 | D.该溶液的溶质是盐 |