选做【化学——有机化学基础】(12分)枯茗醛可用作食用香精。现由枯茗醛合成兔耳草醛,其合成路线如下:
已知醛在一定条件下发生如下反应:
请回答下列问题:
(1)写出试剂X的结构简式:____________。
(2)写出有机物B中所含官能团的名称为_____________;A→B的反应类型为__________。
(3)检验B中的官能团所需的试剂是_________(填序号)。
| A.银氨溶液 稀盐酸 溴水 |
| B.新制氢氧化铜悬浊液稀硫酸酸性高锰酸钾溶液 |
| C.新制氢氧化铜悬浊液 稀盐酸 溴水 |
| D.银氨溶液稀硫酸酸性高锰酸钾溶液 |
(4)写出有机物C生成兔耳草醛的化学方程式:_________________________。
(5)芳香族化合物Y与枯茗醛互为同分异构体,Y具有如下特征:
a.不能发生银镜反应,可发生消去反应;
b.核磁共振氢谱显示:Y消去反应产物的苯环上只存在一种化学环境的氢原子;
写出Y可能的结构简式:_____________、______________。
雾霾含有大量的污染物SO2、NO。工业上变“废”为宝,吸收工业尾气SO2和NO,可获得Na2S2O4和NH4NO3产品的流程图如下(Ce为铈元素):
(1)装置Ⅰ中的主要离子方程式为。
(2)含硫各微粒(H2SO3、HSO3-和SO32-)存在于SO2与NaOH溶液反应后的溶液中,它们的物质的量分数X(i)与溶液pH 的关系如图所示。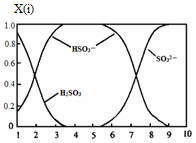
①若是0.1molNaOH反应后的溶液,测得溶液的pH=8时,溶液中个离子由大到小的顺序是。
②向pH=5的NaHSO3溶液中滴加一定浓度的CaCl2溶液,溶液中出现浑浊,pH降为2,用化学平衡移动原理解释溶液pH降低的原因:。
(3)写出装置Ⅱ中,酸性条件下的离子方程式。
(4)装置Ⅲ还可以使Ce4+再生,其原理如下图所示。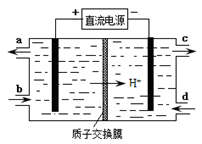
①生成Ce4+从电解槽的(填字母序号)口流出。
②写出与阴极的反应式。
(5)已知进入装置Ⅳ的溶液中,NO2-的浓度为a g·L-1,要使1 m3该溶液中的NO2-完全转化为NH4NO3,需至少向装置Ⅳ中通入标准状况下的O2L。(用含a代数式表示,计算结果保留整数)
【化学—物质结构与性质】
过渡元素具有较多的空轨道,所以第四周期的Cr、Fe、Co、Ni、Cu、Zn等多种金属能形成配合物。
(1)基态Cu原子的核外电子排布式为 ;
(2)科学家通过X射线测得胆矾结构示意图可简单表示如下:
图中虚线表示的作用力为 ;
(3)胆矾溶液与氨水在一定条件下可以生成Cu(NH3)4SO4·H2O晶体。在Cu(NH3)4SO4·H2O晶体中,[Cu(NH3)4]2+为平面正方形结构,则呈正四面体结构的原子团是 ,其中心原子的杂化轨道类型是 ;
(4)金属镍粉在CO气流中轻微加热,生成无色挥发性液态Ni(CO)4,呈正四面体构型。试推测四羰基镍的晶体类型是 , Ni(CO)4易溶于下列 。
| A.水 | B.四氯化碳 | C.苯 | D.硫酸镍溶液 |
(5)元素X 位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2。元素Y基态原子原子最外层电子数是其内层的3倍。X与Y所形成化合物晶体的晶胞如图所示,该化合物的化学式为 。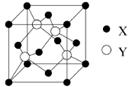
【化学—化学与技术】
下图表示某些化工生产的流程(有的反应条件和产物已略去)
请回答下列问题:
(1)流程中所涉及的化学工业 (写出两个即可)。
(2)反应I需在500℃进行,主要原因是 ;实际工业生产中,反应Ⅱ的条件是 。
(3)写出反应III的化学方程式 。
(4)工业上,析出K后,再向母液中继续通入E,并加入细小食盐颗料,其目的是 。
(5)工业上常用Na2CO3溶液吸收制取HNO3产生的尾气中的NO2,生成NaNO3、NaNO2和一种气体,写出反应的化学方程式 。
【化学—有机化学基础】
肉桂酸甲酯(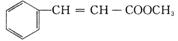 )又称苯基丙烯酸甲酯,具有可可香味,主要用于日化和食品工业,是常用的定香剂或食用香精,同时也是重要的有机合成原料。
)又称苯基丙烯酸甲酯,具有可可香味,主要用于日化和食品工业,是常用的定香剂或食用香精,同时也是重要的有机合成原料。
(1)有关肉桂酸甲酯的叙述中,正确的是(填标号)。
A.肉桂酸甲酯的摩尔质量为163g/mol B.无法使酸性高锰酸钾溶液褪色
C.在碱性条件下能发生水解反应 D.能发生加聚反应生成高分子化合物
(2)G为肉桂酸甲酯的一种同分异构体,其分子结构模型如右图所示(图中球与球之间连线表示单键或双键)。G的结构简式为。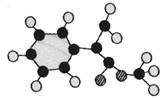
(3)用芳香烃A为原料合成G的路线如下:
①化合物E中的官能团有(填名称)。
②B→C该反应的化学方程式为:。
③A→B、E→F的反应类型是、。
④符合下列条件的F的同分异构体的结构简式是。
a.分子内含苯环,且苯环上只有一个支链;
b.在一定条件下,lmol该物质与足量银氨溶液充分反应,生成4mol银单质。
过氧化钙(CaO2)难溶于水,在常温下稳定,在潮湿空气及水中缓慢分解放出氧气,用作杀菌剂、防腐剂、解酸剂、油类漂白剂及封闭胶泥的快干剂,在食品、牙粉、化妆品等制造中用作添加剂。下图是以大理石(主要杂质是氧化铁)等为原料制取过氧化钙(CaO2)的流程。
请回答下列问题:
(1)操作①中应包括、、用氨水调节pH至8~9的目的是______________。
(2)若测得滤液C中c(CO )=2.50×10-4 mol·L-1,则Ca2+______(填“是”或“否”)沉淀完全。[已知c(Ca2+)≤10-5 mol·L-1可视为沉淀完全;Ksp(CaCO3)=4.96×10-9]
)=2.50×10-4 mol·L-1,则Ca2+______(填“是”或“否”)沉淀完全。[已知c(Ca2+)≤10-5 mol·L-1可视为沉淀完全;Ksp(CaCO3)=4.96×10-9]
(3)若在滤液C中,加入HNO3使溶液呈酸性以得到副产物NH4NO3,则酸化后溶液中,c(NH )c(NO
)c(NO ) (填 > 、< 或 = ),(NH4)2CO3溶液中离子浓度由大到小的顺序为。
) (填 > 、< 或 = ),(NH4)2CO3溶液中离子浓度由大到小的顺序为。
(4)在低温下,往过氧化氢浓溶液中投入无水氯化钙进行反应,写出该反应的化学方程式:_______________,一段时间后,再加入氢氧化钠溶液,当调节溶液pH至9~11,才出现大量沉淀。用简要的文字解释需用氢氧化钠调节pH至9~11的原因_________________________。
(5)写出CaO2与H2O反应的化学方程式。