已知常温下AgCl的Ksp=1.8×10-10,AgI的Ksp=8.5×10-17。若向5mL含有KCl和KI各为0.01mol/L的混合溶液中加入8mL 0.01mol/L AgNO3溶液,此时溶液中所含溶质的离子浓度大小关系正确的是
| A.c(K+)>c(NO3-)>c(Cl-)>c(Ag+)>c(I-) |
| B.c(K+)>c(NO3-)>c(Ag+)>c(Cl-)>c(I-) |
| C.c(NO3-)>c(K+)>c(Ag+)>c(Cl-)>c(I-) |
| D.c(K+)>c(NO3-)>c(Ag+)=c(Cl-)+c(I-) |
如下图为相互串联的甲、乙两电解池。试回答: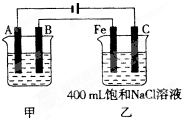
(1)若甲电解池利用电解原理在铁上镀银,则B是(填电极材料),电极反应为, 甲中电解质溶液的溶质为__________。
(2)若甲电解池某极增重4.32g,则乙槽中Fe极上放出的气体在标准状况下的体积是__________mL。
(3)若乙电解池中剩余溶液仍为400mL,则电解后所得溶液的pH等于__________。
某温度下,在密闭容器中发生如下可逆反应:2M(g)+N(g)  2E(g),若开始时只充入2 mol E(g),达平衡时,E的转化率为40%;若开始时充入2 mol M和1 mol N的混合气体,达平衡时混合气体的压强比起始时减少了
2E(g),若开始时只充入2 mol E(g),达平衡时,E的转化率为40%;若开始时充入2 mol M和1 mol N的混合气体,达平衡时混合气体的压强比起始时减少了
| A.20% | B.40% | C.60% | D.80% |
草酸是二元中强酸,草酸氢钠溶液显酸性。常温下,向10 mL0.01 mol/LNaHC2O4溶液中滴加0.01 mol/LNaOH 溶液,随着NaOH溶 液体积的增加,溶液中离子浓度关系正确的是
| A.V(NaOH)=0时,c(H+)=1×10-2 mol/L |
| B.V(NaOH)=10 mL时,c(H+)=1×10-7 mol/L |
| C.V(NaOH)<10 mL时,不可能存在c(Na+)=2c(C2O42-)+c(HC2O4-) |
| D.V(NaOH)>10 mL时,c(Na+)>c(C2O42-)>c(HC2O4-) |
用惰性电极电解下列溶液一段时间后,停止电解,向溶液中加入一定质量的另一种物质(括号内),可能使溶液完全复原的是
| A.CuCl2(CuO) | B.NaOH(NaOH) | C.CuSO4(Cu(OH)2) | D.NaCl(Cl2) |
缓冲溶液可以抗御少量酸碱对溶液pH的影响,Na2HPO4/Na3PO4的混合溶液可以将体系的pH稳定在11.3~13.3之间,是一种常用的缓冲溶液。下列有关该缓冲溶液的说法错误的是
| A.加入少量强碱,主要发生的反应HPO42-+OH-==PO43-+H2O |
| B.加入少量强酸,主要发生的反应HPO42-==2H++ H3PO4 |
| C.c(Na+)+c(H+)=c(OH-)+c(H2PO4-)+2c(HPO42- )+3c(PO43- ) |
| D.c(Na+)>c(PO43- )+c(HPO42- )+c(H2PO4- )+c(H3PO4) |