卤块的主要成分是MgCl2,此外还含Fe3+、Fe2+和Mn2+等离子。以卤块为原料可制得轻质氧化镁,工艺流程如下图: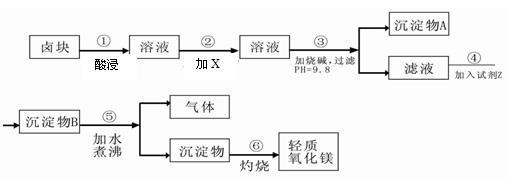
已知:Fe2+氢氧化物呈絮状,不易从溶液中除去,所以常将它氧化为Fe3+,生成Fe(OH)3沉淀除去。若要求产品尽量不含杂质,请根据表1表2提供的资料,填写空白:
表1 生成氢氧化物沉淀的pH
| 试剂 |
价格(元/吨) |
| 漂液(含NaClO,25.2%) |
450 |
| 双氧水(含H2O2 ,30%) |
2400 |
| 烧碱(含98% NaOH) |
2100 |
| 纯碱(含99.5% Na2CO3) |
600 |
| 物质 |
开始沉淀 |
沉淀完全 |
| Fe(OH)3 |
2.7 |
3.7 |
| Fe(OH)2 |
7.6 |
9.6 |
| Mn(OH)2 |
8.3 |
9.8 |
| Mg(OH)2 |
9.6 |
11.1 |
表2 化学试剂价格表
| 试剂 |
价格(元/吨) |
| 漂液(含NaClO,25.2%) |
450 |
| 双氧水(含H2O2,30%) |
2400 |
| 烧碱(含98%NaOH) |
2100 |
| 纯碱(含99.5%Na2CO3) |
600 |
(1)在步骤②中加入的试剂X,最佳的选择是 ,原因是 。写出加入X发生反应的离子方程式 。选择 (试剂)来检验Fe2+是否完全氧化为Fe3+
(2)在步骤③中控制pH=9.8,其目的是 。
(3)试剂Z应该是 。
(4)在步骤⑤中发生反应的化学方程式是 。
(5)若在实验室中完成步骤⑥,则沉淀物必需在仪器A中灼烧。A应放置于仪器B上灼烧,灼烧完毕后应用仪器C取下仪器A置于仪器D上冷却。则B、C、D分别是 、 、 。
绿矾(FeSO4·7H2O)可用于色谱分析剂、净水、照相制版等方面。下面是以铁屑(含少量锡等杂质)生产绿矾的一种方法:
己知:在H2S饱和溶液中,SnS沉淀完全时的pH为1.6;FeS开始沉淀时溶液的pH为3.0,沉淀完全时溶液的pH为5.5。
(1)操作Ⅱ中用pH试纸测定溶液pH的操作是:
(2)操作Ⅱ中用硫酸酸化至pH=2的目的是
(3)操作Ⅲ中需要的玻璃仪器是烧杯、。
(4)通入硫化氢至饱和的目的是:①除去操作Ⅰ所得溶液中含有的Sn2+等杂质离子;
②
(5)操作IV的顺序依次为:、冷却结晶、。
(6)操作IV得到的绿矾晶体用少量冰水洗涤,其目的是:①除去晶体表面附着的硫酸等杂质;②。
氯化亚铁溶液中滴加硫氰化钾溶液,再滴加双氧水,立即出现血红色,后红色又褪去呈黄色并伴有气泡产生,针对该实验现象,某实验小组的同学进行了探究
一、现象分析
假设A:气泡是H2O2分解产生的O2
假设B:气泡是KSCN被氧化为N2、SO2、CO2等
假设C:红色褪去的原因是KSCN被氧化成了其它物质
二、实验探究
探究1
| 实验操作 |
实验现象 |
结论 |
| ①1mL 0.1mol/L的FeCl2溶液中加2滴KSCN溶液 |
溶液不变红 |
Fe2+遇SCN-不变红 |
| ②向①的溶液中加3%的H2O21滴并振荡 |
立即出现血红色 振荡后不褪色 |
加入H2O2后溶液中 出现了(离子符号) |
| ③向②的溶液中继续加H2O2溶液 |
溶液中出现大量气泡 血红色褪去 |
|
| ④用带火星的木条检验③中的气体 |
木条复燃 |
则假设成立 |
探究2
| 实验操作 |
实验现象 |
结论 |
| ①取2ml KSCN溶液向其中加入几滴BaCl2溶液和稀盐酸 |
无明显现象 |
|
| ②向①所得的溶液中滴加3%的H2O2 |
溶液中出现白色沉淀并有少量气泡 |
白色沉淀为BaSO4 |
| ③将6%的H2O2溶液加入KSCN固体中,生成的气体依次通过品红溶液,酸性KMnO4溶液和澄清的石灰水 |
KSCN被H2O2氧化生成了SO2和CO2气体 |
三、问题与讨论
(1)探究1中,H2O2分解速度很快的原因
(2)探究1中,说明还原性Fe2+SCN-
(3)探究2中,酸性KMnO4溶液的作用是
能证明生成了CO2的现象是
(4)若SCN -被H2O2氧化得到N2、SO2、CO2和SO42-,且SO2与SO42-的物质的量比为1:1,试写出该反应的离子方程式
已知Fe(NO3)2受热分解产物为金属氧化物、NO2和O2,请完成表格内容并回答相关问题:
(1)对固体产物中Fe化合价的猜想:
猜想一:只显+2价猜想二:只显+3价;猜想三:。
(2)为证明猜想二通过完成下表加以验证。供选试剂有:0.01 mol/L 酸性KMnO4溶液、0.1 mol/L H2SO4溶液、3%H2O2溶液、0.1 mol/LKSCN溶液、蒸馏水。(仪器自添)
| 实验操作 |
现象 |
目的或结论 |
| 步骤1:取适量上述热分解后的固体于试管中,加入0.1 mol/L H2SO4溶液使其充分溶解,将上层清液分加到A、B两支试管中 |
溶解固体产物 |
|
| 步骤2: |
溶液中含有Fe3+ |
|
| 步骤3: |
溶液中不含 Fe2+ |
经验证,猜想二正确,请写出Fe(NO3)2热分解的化学方程式。
(3)某同学将带火星的木条伸入该分解反应产生的气体中,木条复燃,由此他得出“NO2能支持燃烧的结论”。请你判断该结论是否正确?并说明理由。
碘是人体必需的微量元素之一,有“智力元素”之称。食用加碘食盐可预防碘缺乏病。查阅资料知:①在酸性条件下,I—能被NO3-离子氧化成IO3-离子,被H2O2或O2等氧化成I2;②IO3-离子能被HSO3-离子还原成I2。
请你利用实验室常用仪器和下列限选试剂,依次研究某食盐样品中所加碘的存在形式是I2、I-、IO3-中的哪一种。
限选试剂如下:1.0 mol•L-1HNO3溶液、1.0 mol•L-1 H2SO4溶液、1.0 mol•L-1NaHSO3溶液、3% H2O2溶液、1%淀粉溶液、蒸馏水
Ⅰ.提出假设
假设1:该食盐样品中含I2 ;
假设2:该食盐样品中含I—
假设3:。
Ⅱ.设计方案与实验探究
将适量食盐样品溶于蒸馏水制成溶液,请按要求填写下表
| 实验步骤 |
预期现象与结论 |
| 步骤1:取少量上述溶液注入试管中,滴入几滴淀粉溶液振荡。 |
若溶液显,则假设1成立;否则,假设1不成立,再进行步骤2 |
| 步骤2: |
若溶液显蓝色,则假设2成立,反应的离子方程式为;否则,假设2不成立,再进行步骤3 |
| 步骤3: |
Ⅲ.问题与思考
纯的KIO3或KI都可以作为食用加碘盐中碘的来源。从化学角度来看,试验中添加(填“KIO3”或“KI”)更好;理由是。
MgSO4•7H2O在医药上常用做泻药,工业上可用氯碱工业中的一次盐泥为原料生产。已知一次盐泥中含有镁、钙、铁、铝、锰的硅酸盐和碳酸盐等成分。其主要工艺如下:
用H2SO4调节溶液PH至1~2,H2SO4作用是 。
(2)加NaClO溶液至PH=5~6并加热煮沸5~10分钟,沉淀2中主要含有MnO2和另外两种难溶物,这两种难溶物的化学式分别为、;其中NaClO溶液将MnSO4转化为MnO2的离子方程式为 。
(3)检验滤液Ⅱ中是否含有Fe3+的实验方法是。
(4)“操作X”是将溶液、、过滤洗涤,即得到MgSO4•7H2O晶体。
(5)准确称量制得的样品5g,用200mL水溶解,加入2 mol•L—1的盐酸5mL,在不断搅拌下滴加足量2 mol•L—1 BaCl2溶液,充分反应后,得沉淀4.46g,则样品纯度为。