硫及其化合物对人类的生产和生活有着重要的作用。
(1)重晶石(BaSO4)高温煅烧可发生一系列反应,其中部分反应如下:
BaSO4 (s)+4C(s) ===BaS(s)+4CO (g) ΔH=+571.2 kJ·mol-1
BaS(s) ===Ba(s)+S(s) ΔH=+460 kJ·mol-1
已知:O2(g)+2C(s) ===2CO(g) ΔH=-221 kJ·mol-1,写出O2氧化Ba(s)和S(s)至BaSO4的热化学方程式 。
(2)2SO2(g)+O2(g) 2SO3(g) ΔH=-198 kJ·mol-1是制备硫酸的重要反应。在容积为V L的密闭容器中起始充入2 mol SO2和1 mol O2,反应在不同条件下进行,反应体系总压强随时间的变化如图所示。与实验a 相比,实验b 改变的条件是 ,判断的依据 。
2SO3(g) ΔH=-198 kJ·mol-1是制备硫酸的重要反应。在容积为V L的密闭容器中起始充入2 mol SO2和1 mol O2,反应在不同条件下进行,反应体系总压强随时间的变化如图所示。与实验a 相比,实验b 改变的条件是 ,判断的依据 。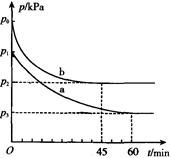
(3)二氧化硫在一定条件下还可以发生如下反应:
SO2 (g) + NO2 (g) SO3 (g) + NO (g) ΔH=-42 kJ·mol-1。在1 L 恒容密闭容器中充入SO2(g) 和NO2 (g),所得实验数据如下:
SO3 (g) + NO (g) ΔH=-42 kJ·mol-1。在1 L 恒容密闭容器中充入SO2(g) 和NO2 (g),所得实验数据如下:
| 实验 编号 |
温度 |
起始时物质的量/mol |
平衡时物质的量/mol |
|
| n(SO2) |
n(NO2) |
n(NO) |
||
| 甲 |
T1 |
0.80 |
0.20 |
0.18 |
| 乙 |
T2 |
0.20 |
0.80 |
0.16 |
| 丙 |
T2 |
0.20 |
0.30 |
a |
①实验甲中,若2 min 时测得放出的热量是4.2 kJ,则0~2 min时间内,用SO2 (g)表示的平均反应速率υ(SO2)= 。
②实验丙中,达到平衡时,NO2的转化率为 。
③由表中数据可推知,T1 T2(填“>”“<”或“=”),判断的理由是 。
现有A、B、C、D、E五种可溶强电解质,它们在水中可电离产生下列离子(各种离子不重复)。
| 阳离子 |
H+、Na+、A13+、Ag+、Ba2+ |
| 阴离子 |
OH—、C1—、CO32—、NO3—、SO42— |
已知:①A、B两溶液呈碱性;C、D、E溶液呈酸性。
②向E溶液中逐滴滴加B溶液至过量,沉淀量先增加后减少但不消失。
③D溶液与另外四种溶液反应都能产生沉淀。
试回答下列问题:
(1)A溶液呈碱性的原因是。(写出有关离子方程式)
(2)若25℃时C、E溶液pH=4,则E溶液中水电离出的氢离子浓度是C溶液中水电离出的氢离子浓度倍。
(3)将0.1 mol·L-1 的C溶液逐滴加入等体积、0.2 mol·L-1的A溶液中,反应后溶液中离子浓度由大到小的顺序为:。
(8分)牛奶放置时间长了会变酸,这是因为牛奶中含有不少乳糖,在微生物的作用下乳糖分解而变成乳酸。乳酸最初就是从酸牛奶中得到并由此而得名的。乳酸的结构简式为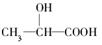 。完成下列问题:
。完成下列问题:
⑴写出乳酸分子中官能团的名称:
⑵一定条件下乳酸能发生的反应类型有(填序号)
| A.水解反应 | B.取代反应 | C.加成反应 | D.中和反应E.氧化反应 F.酯化反应G.还原反应 |
⑶写出乳酸与碳酸钠溶液反应的化学方程式:
⑷乳酸在浓硫酸作用下,两分子相互反应生成链状结构,写出此生成物的结构简式:
电解原理在化学工业中有广泛应用。下图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
⑴若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则电解池中
①X极上的电极反应式为,在X极附近观察到的现象是。
②Y极上的电极反应式为,检验该电极反应产物的方法是。
⑵如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则
① X电极的材料是,电极反应式是。
② Y电极的材料是,电极反应式是。
(说明:杂质发生的电极反应不必写出)
⑴目前出现的“不粘锅”是表面有一种叫做“特氟龙”的涂层,实际就是号称”塑料王”的聚四氟乙烯,试写出合成“特氟龙”的化学方程式和反应类型。
方程式反应类型
⑵请写出硬脂酸甘油酯制肥皂的化学方程式和反应类型。
方程式反应类型
⑶请写出苯与浓硝酸反应的化学方程式和反应类型。
方程式反应类型
乙烯是石油裂解气的主要成分,它的产量通常用来衡量一个国家的石油化工水平。请回答下列问题。
(1)乙烯的电子式____________,结构简式____________。
(2)鉴别甲烷和乙烯的试剂是______(填序号)。
A.稀硫酸 B.溴的四氯化碳溶液
C.水 D.酸性高锰酸钾溶液
(3)下列物质中,可以通过乙烯加成反应得到的是______(填序号)。
A.CH3CH3 B.CH3CHCl2
C.CH3CH2OH D.CH3CH2Br
(4)已知 2CH3CHO+O2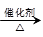 2CH3COOH。若以乙烯为主要原料合成乙酸,其合成路线如下图所示。
2CH3COOH。若以乙烯为主要原料合成乙酸,其合成路线如下图所示。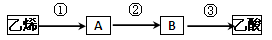
反应②的化学方程式为____________________________________。
工业上以乙烯为原料可以生产一种重要的合成有机高分子化合物,其反应的化学方程式为_________________ ________________,反应类型是______________。