磷酸铁锂动力电池(LiFePO4电池)的内部结构如图所示。中间是聚合物的隔膜,它把正极与负极隔开,锂离子可以通过而电子不能通过。
该电池的总反应式为:Li1-xFePO4+ LixC6="=" C6 + LiFePO4
(1)磷酸铁锂电池放电时,正极反应式为 。
(2)若用该电池电解精炼铜,阴极质量增重19.2g时,则电池中通过聚合物隔膜的Li +数目为 。
(3)以该电池为电源,用Fe2O3为阳极,石墨为阴极,NaOH溶液为电解质溶液制备高铁酸钠(Na2FeO4),写出阳极的电极反应式 。
(4)学生在实验时若被白磷(以P表示)灼伤,可用硫酸铜溶液涂抹伤处,有铜和H3PO4生成,写出此反应的化学方程式 。
(5)一般来说,如果一个反应的平衡常数大于105,通常认为反应进行得较完全;相反,如果一个反应的平衡常数小于10-5,则认为这个反应很难进行。已知常温下各物质的溶度积及电离平衡常数:
CuS:Ksp=8.4×10-36mol2·L-2;H2S:Ka1=1.2×10-7mol·L-1,Ka2=7×10-15mol·L-1
①通过计算说明反应CuS(s)+2H+ Cu2++H2S进行的程度 。
Cu2++H2S进行的程度 。
②常温下,NaHS溶液呈碱性,此溶液中离子浓度由小到大的顺序是 。若向此溶液中加入硫酸铜溶液,恰好完全反应,所得溶液pH 7(填“>”“<”或“﹦”),其原因是 (用离子方程式表示)。
(1)向含有AgI固体的饱和溶液中:
①加入固体AgNO3,则c(I-)________(填“变大”、“变小”或“不变”,下同)。
②若加入更多的AgI固体,则c(Ag+)________
③若加入固体AgCl,c(I-)________,而c(Ag+)________
(2)右图分别是量筒、滴定管的一部分,则:滴定管应该是_______(填编号),读数为_______mL(虚线标注处);
(3)室温下,甲溶液的pH是4,乙溶液的pH是5;甲溶液与乙溶液的c(H+)之比为_________;
按要求完成以下化学方程式:(是离子反应的只写离子方程式)
(1)铁在氯气中燃烧____________________________;
(2)将二氧化硫气体通入足量的澄清石灰水中__________________________;
(3)工业上氨在催化剂作用下与氧气反应__________________________;
(4)钠与硫酸铜溶液反应_______________、___________;
(1)用单线桥表示下列反应中电子转移方向和数目:
KIO3+6HI =KCl+3H2O+3I2
(2)钙元素是人体必需的常量元素,所有的细胞都需要钙元素,测定人体血液中钙元素的含量常用到如下两个反应:
①CaC2O4+H2SO4=H2C204+CaSO4
②2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O
上述反应②的还原剂是__________;若收集到44.8mL(标准状况)的CO2时,消耗氧化剂__________ mol,有__________mol电子发生转移,相当于测出含钙元素的质量是_____g。
【加试题】节能减排已经成为全社会的共识,浙江省在原先推行乙醇汽油的基础上,开始试点甲醇汽油(即在汽油中添加一定量的甲醇),根据检测的数据分析认为,若绍兴全市的100余万辆机动车全部使用甲醇汽油,一年内能减少有害气体(一氧化碳)排放将近100万吨。甲醇常利用煤气化过程中生成的CO和H2来制备:CO+2H2⇌CH3OH 。
请根据图示回答下列: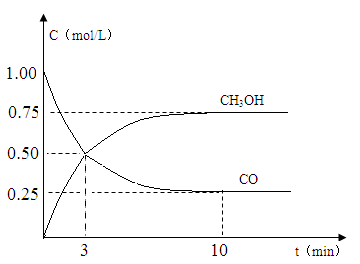
(1)关于该自发反应的下列说法中,正确的是 (填字母):
A.△H>0,△S>0 B.△H>0,△S<0
C.△H<0,△S<0 D.△H<0,△S>0
(2)现进行如下实验,在体积为1L的密闭容器中,充入1molCO和3molH2,测得CO和CH3OH(g)的浓度随时间变化如图所示。从反应开始到平衡,CO的平均反应速率v(CO)= mol/(L•min),该反应的平衡常数K= 。
(3)恒容条件下,达到平衡后,下列措施中能使n(CH3OH)/n(CO)增大的有 。
A.升高温度 B.充入He气 C.再冲入1molCO和3molH2 D.使用催化剂
(4)若在一体积可变的密闭容器中充入1molCO、2molH2和1molCH3OH,达到平衡时测的混合气体的密度是同温同压下起始的1.6倍(此过程三种物质均处于气态),则平衡时混合气体的平均摩尔质量= g/mol。
碳和氮的化合物与人类生产、生活密切相关。
(1)在一恒温、恒容密闭容器中发生反应:Ni(s)+4CO(g) Ni(CO)4(g),△H<0;
Ni(CO)4(g),△H<0;
利用该反应可以将粗镍转化为纯度达99.9%的高纯镍。下列说法正确的是_______(填字母编号)。
| A.增加Ni的量可提高CO的转化率,Ni的转化率降低 |
| B.缩小容器容积,平衡右移,△H减小 |
| C.反应达到平衡后,充入CO再次达到平衡时,CO的体积分数降低 |
| D.当4v正[Ni(CO)4]=v正(CO)时或容器中混合气体密度不变时,都可说明反应已达化学平衡状态 |
(2)CO与镍反应会造成含镍催化剂的中毒.为防止镍催化剂中毒,工业上常用SO2将CO氧化,二氧化硫转化为单质硫.
已知:CO(g)+ 1/2O2(g)=CO2(g)△H=-Q1 kJ•mol-1
S(s) +O2(g) =SO2(g)△H=-Q2 kJ•mol-1
则SO2(g) +2CO(g) ="S(s)" +2CO2(g)△H=________________;
(3)对于反应:2NO(g)+O2═2NO2(g),向某容器中充入10mol的NO和10mol的O2,在其他条件相同时,分别测得NO的平衡转化率在不同压强(P1、P2)下随温度变化的曲线(如图1).
①比较P1、P2的大小关系_______________;
②700℃时,在压强为P2时,假设容器为1L,则在该条件平衡常数的数值为_______(最简分数形式);
(4)NO2、O2和熔融NaNO3可制作燃料电池,其原理如图2所示.该电池在使用过程中石墨I电极上生成氧化物Y,其电极反应式为_______________;若该燃料电池使用一段时间后,共收集到20mol Y,则理论上需要消耗标准状况下氧气的体积为________L。