一氧化碳是一种用途广泛的化工基础原料。
(l)在高温下CO可将SO2还原为单质硫。已知:
2CO(g)+O2(g) 2CO2(g) △H1=-566.0kJ·mol-1;
2CO2(g) △H1=-566.0kJ·mol-1;
S(s)+O2(g) SO2(g) △H2=-296.0kJ·mol-1;
SO2(g) △H2=-296.0kJ·mol-1;
请写出CO还原SO2的热化学方程式______ 。
(2)工业上用一氧化碳制取氢气的反应为:CO(g)+H2O(g) CO2(g)+H2(g),已知420℃时,该反应的化学平衡常数K=9。如果反应开始时,在2L的密闭容器中充入CO和H2O的物质的量都是0.60mol,5min末达到平衡,则此时CO的转化率为____,H2的平均生成速率为 mol·L-1min-1,其他条件不变时,升温至520℃,CO的转化率增大,该反应为____反应(填“吸热”或“放热”);
CO2(g)+H2(g),已知420℃时,该反应的化学平衡常数K=9。如果反应开始时,在2L的密闭容器中充入CO和H2O的物质的量都是0.60mol,5min末达到平衡,则此时CO的转化率为____,H2的平均生成速率为 mol·L-1min-1,其他条件不变时,升温至520℃,CO的转化率增大,该反应为____反应(填“吸热”或“放热”);
(3)CO与H2反应还可制备CH3OH,CH3OH可作为燃料使用,用CH3OH和O2组合形成的质子交换膜燃料电池的结构示意图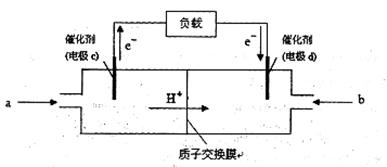
电池总反应为:2CH3OH+3O2=2CO2+4H2O,则c电极是 (填“正极”或“负极”),c电极的反应方程式为 。若用该电池电解精炼铜(杂质含有Ag和Fe),粗铜应该接此电源的____极(填“c”或“d”),反应过程中析出精铜64g,则上述CH3OH燃料电池,消耗的O2在标况下的体积为 L。
(10分)已知有机物E的相对分子量小于160,其中氧的质量分数约为48.5%,E中无支链,E及其它有机物之间的相互转化关系如图:
(1)C中所含官能团的名称 ;指出⑤的反应类型 。
(2)E的摩尔质量为 ;写出E的结构简式 。
(3)写出反应②的化学方程式 。
写出反应③的化学方程式 。
(4)能发生银镜反应的C的同分异构体,写出不同类型的两个结构简式(多个羟基不能连在同一个碳原子上) 、 。
含氧有机物甲可用来制取多种有用的化工产品,合成路线如下:

(1)甲的含氧官能团的名称是 。乙+丙→丁的反应类型 。
(2)写出己和丁的结构简式:
己 ,丁 。
(3)辛在NaOH溶液中发生水解反应化学方程式为 。
(4)庚与M合成高分子树脂的化学方程式为 。
(5)乙有多种同分异构体,写出同时符合下列条件的乙的同分异构体的结构简式 。
i.不能与Fe3+发生显色反应
ii.能发生银镜反应
iii.苯环上有两种一氯取代物
(15分)已知A、B、C、D、E、F是原子序数依次增大的短周期主族元素。A的最外层电子数等于其电子层数,B元素形成的化合物种类最多,D是地壳中含量最高的元素,D和E同主族。Q是第四周期元素,最外层只有一个电子,其余各层电子均充满。
请回答下列问题(用元素符号或化学式表示):
(1)元素B、C、D的电负性由大到小的顺序是 。
(2)A3D+的中心原子杂化轨道类型是 ,该离子的立体构型是 。
(3)向QF2的水溶液通入ED2,产生白色沉淀QF,该反应的化学方程式是 。
(4)一种处理汽车尾气中CD、BD2的方法是在催化剂作用下使两者反应成无污染的气态。已知反应生成1g C的单质时放出4.3kJ热量。此反应的热化学方程式为 。
(5)Q+的核外电子排布式为 ,下图是由C、Q形成的某种化合物的晶胞结构示意图,该晶体的化学式 ;C的配位数为 。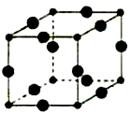
(6)C2A4 ─ 空气燃料电池是一种碱性燃料电池。电解质溶液是20%~30%的KOH溶液。则燃料电池放电时:负极的电极反应式是 。
(1)(5分)由A、B两种气态烃组成的混合气体,对H2的相对密度为17。常温常压下,取这种混合气体10mL与80mL氧气(过量)混合,当完全燃烧后恢复到原状态时,测得气体的体积为70mL。试求:
①混合气体的平均组成为(用CxHy的形式表示)___________;
②若上述两种气体按体积1:1混合时,则两种气态烃的可能组成为__________________。
(2)(5分)具有支链的化合物X的分子式为C4H8O,X既能使Br2的四氯化碳溶液褪色,又能与Na反应。①X的结构简式是,
②写出与X具有相同官能团的X的所有同分异构体的结构简式:______________。
(1)请写出下列物质的结构简式:
①2-甲基-3-乙基戊烷:;
②2,3-二甲基-1-丁烯:。
(2)请写出下列物质的名称:
(3)在有机反应中,反应条件尤为重要。条件(如温度、溶剂、催化剂等)改变,反应产物可能会随之改变。
①已知苯与浓硝酸、浓硫酸的混合物在50-60℃反应时生成硝基苯;若反应条件升温至100-110℃时,反应的化学方程式为。
②卤代烃与碱反应时,溶剂不同则产物不同。若溴乙烷与氢氧化钾的水溶液反应,反应的化学方程式为:。
③甲苯能与溴蒸汽在光照条件下发生反应生成一溴代物,反应的化学方程式为:。
(4)某有机分子结构如下:
该分子中至少有个C原子在同一平面,最多有个C原子在同一平面。