某研究性学习小组选用以下装置进行实验设计和探究(图中a、b、c均为止水夹)
(1)在进行气体制备时,应先检验装置的气密性。将A装置末端导管密封后,在A装置的分液斗内装一定量的蒸馏水,然后 ,则证明A装置的气密性良好。
(2)用锌粒和稀硫酸制备H2时应选用装置____作为发生装置(填所选装置的序号字母),实验时可先在稀硫酸溶液中加入少量硫酸铜晶体会使反应速率加快,原因是 。
(3)某同学利用上述装置设计实验证明Cl2氧化性强于Br2
①选用的装置连接顺序为:( )→( )→( )(填所选装置的序号字母);
②从以下试剂中选用该实验所需的试剂为 (填试剂的序号字母);
a.浓硫酸
b.浓盐酸
c.二氧化锰
d.氯化钠
e.溴化钠溶液
③实验过程中能说明Cl2氧化性强于Br2的实验现象是 ;
(4)另一同学将B、D、E装置连接后,在B装置中加入铜片和浓硝酸制取NO2,然后进行NO2气体与水反应的实验,并观察相关现象:
①B装置发生反应的离子方程式为____;
②反应一段时间后D装置中的具支试管乙中收集满NO2气体,若进行NO2气体与水反应的实验,应 (填“对a、b、c三个止水夹进行的操作”),然后再适当加热乙;实验现象为 。
③E装置中的NaOH溶液可吸收尾气NO2,反应生成NaNO3、NaNO2和H2O,反应中生成的NaNO3和NaNO2的物质的量之比为 。
(8分)已知:Cu+2H2SO4(浓)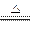 CuSO4+SO2↑+2H2O,如图是铜与浓硫酸反应的实验装置图,请回答下列问题。
CuSO4+SO2↑+2H2O,如图是铜与浓硫酸反应的实验装置图,请回答下列问题。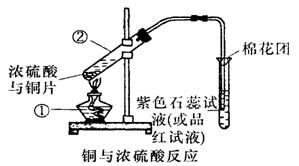
(1)写出标号①的仪器的名称: 。
(2)将产生气体通入品红试液中的现象为: 。
(3)图中棉花团中浸有氢氧化钠溶液,其作用是_________________________ 。
(4)反应过程中浓硫酸被消耗,逐渐变稀,而铜不和稀硫酸反应,因此反应完毕,试管中一定还有硫酸剩余。下列药品中能用来证明反应结束后的溶液中确有余酸的有________(填字母)。
a.铁粉 b.BaCl2溶液 c.银粉 d.Na2CO3溶液
(本题共16分)
已知:碱金属或碱土金属(Ⅱ族)与H2在隔绝空气加热时要以发生反应,生成离子型金属氢化物,如NaH、CaH2等,它们易与水反应。现有甲、乙两位同学分别设计了制备CaH2的实验,装置如图所示(分别以序号Ⅰ、Ⅱ表示).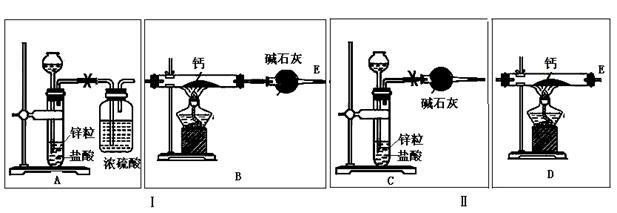
请回答下列问题
(1)锌与盐酸反应的离子方程式为;
(2)最后实验结果显示,两位同学的实验装置设计都有缺陷。
装置Ⅰ的不足之处是,
装置Ⅱ的不足之处是;
(3)请你从两套装置中选取你认为合理的部分,按从左到右的顺序组装一套制取CaH2的合理装置(用序号A、B、C……表示);
(4)检查完装置的气密性后,为了保证产品的纯度和实验安全必须先,然后再
,才能点燃酒精灯加热。同样,为了安全,反应开始后,在E口处应;
(5)军事和气象野外作业常用CaH2做生氢剂,使之与水反应产生H2,其反应的化学方程式为。
(本题共16分)
已知:碱金属或碱土金属(Ⅱ族)与H2在隔绝空气加热时要以发生反应,生成离子型金属氢化物,如NaH、CaH2等,它们易与水反应。现有甲、乙两位同学分别设计了制备CaH2的实验,装置如图所示(分别以序号Ⅰ、Ⅱ表示).
请回答下列问题
(1)锌与盐酸反应的离子方程式为 ;
(2)最后实验结果显示,两位同学的实验装置设计都有缺陷。
装置Ⅰ的不足之处是 ,
装置Ⅱ的不足之处是 ;
(3)请你从两套装置中选取你认为合理的部分,按从左到右的顺序组装一套制取CaH2的合理装置(用序号A、B、C……表示) ;
(4)检查完装置的气密性后,为了保证产品的纯度和实验安全必须先 ,然后再
,才能点燃酒精灯加热。同样,为了安全,反应开始后,在E口处应 ;
(5)军事和气象野外作业常用CaH2做生氢剂,使之与水反应产生H2,其反应的化学方程式为 。
(本题共16分)
已知:碱金属或碱土金属(Ⅱ族)与H2在隔绝空气加热时要以发生反应,生成离子型金属氢化物,如NaH、CaH2等,它们易与水反应。现有甲、乙两位同学分别设计了制备CaH2的实验,装置如图所示(分别以序号Ⅰ、Ⅱ表示).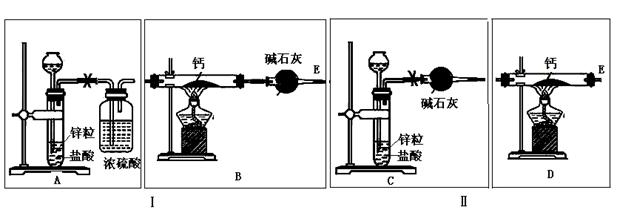
请回答下列问题
(1)锌与盐酸反应的离子方程式为;
(2)最后实验结果显示,两位同学的实验装置设计都有缺陷。
装置Ⅰ的不足之处是,
装置Ⅱ的不足之处是;
(3)请你从两套装置中选取你认为合理的部分,按从左到右的顺序组装一套制取CaH2的合理装置(用序号A、B、C……表示);
(4)检查完装置的气密性后,为了保证产品的纯度和实验安全必须先,然后再
,才能点燃酒精灯加热。同样,为了安全,反应开始后,在E口处应;
(5)军事和气象野外作业常用CaH2做生氢剂,使之与水反应产生H2,其反应的化学方程式为。
硫酸是化学工业最重要的产品之一,工业制法如下。
(1)生产硫酸最古老的方法是以绿矾为原料,在蒸馏釜中煅烧。反应的化学方程式为:2FeSO4·7H2O Fe2O3+SO2+SO3↑+14H2O。其中三氧化硫与水蒸气同时冷凝便得到硫酸。用如图所示装置模拟用绿矾制硫酸的实验,并检验生成的硫酸和二氧化硫(加热装置已略去)。其中b为干燥的试管
Fe2O3+SO2+SO3↑+14H2O。其中三氧化硫与水蒸气同时冷凝便得到硫酸。用如图所示装置模拟用绿矾制硫酸的实验,并检验生成的硫酸和二氧化硫(加热装置已略去)。其中b为干燥的试管 。
。
①试管b中得到的主要产物是,检验该产物的方法是(结合离子方程式简要说明)。
②为检验反应的另一种生成物,试管c中应加入的试剂是,简述相应的实验现象及结论。
③所得硫酸的理论浓度(溶质的质量分数)为。
(2)目前,我国采用“接触法”制硫酸,生产设备如图所示:
①图中设备A的名称是,a、b两处所含气体的化学式分别为、。
②有关接触法制硫酸的下列说法中,不正确的是。
| A.二氧化硫的接触氧化在合成塔中发生 |
| B.吸收塔得到的硫酸浓度为98% |
| C.煅烧含硫48%的黄铁矿时,若FeS2损失了2%,则S损失4% |
D. B装置中反应的条件之一为较高温度是为了提高SO2的转化率 B装置中反应的条件之一为较高温度是为了提高SO2的转化率 |
(3)随着化学工业的发展,“接触法”全面替代了“绿矾热分解法”,请你从综合效益的角度指出“接触法”制硫酸的优势:①生产成本低、②原料易得、③、④ 、⑤、⑥(可不填满)。
、⑤、⑥(可不填满)。