下表所列各组第I栏中的化学反应与第II栏中的化学反应都可以用第III栏中的离子方程式表示的是
| 选项 |
第I栏 |
第II栏 |
第III栏 |
| A |
往少量NaOH溶液中投入铝片 |
往过量NaOH溶液中投入铝片 |
Al+2OH-+2H2O===2AlO2-+3H2↑ |
| B |
往Fe2(SO4)3溶液中滴入氢氧化钠溶液 |
往Fe2(SO4)3溶液中滴入氢氧化钡溶液 |
Fe3++3OH-===Fe(OH)3↓ |
| C |
NaHCO3溶液滴入Ca(OH)2溶液 |
NaHCO3溶液滴入NaOH溶液 |
OH-+HCO3-===CO32-+H2O |
| D |
往NaOH溶液中通入过量CO2气体 |
往NaOH溶液中通入少量CO2气体 |
CO2+OH-="==" HCO3- |
下列反应,属于氧化还原反应的是
| A.2Na2O2 + 2CO2 = 2Na2CO3+ O2 |
| B.Na2O + CO2= Na2CO3 |
| C.2NaOH + CO2 = Na2CO3+ H2O |
D.2NaHCO3 Na2CO3+ CO2↑+ H2O Na2CO3+ CO2↑+ H2O |
下列物质,既能与盐酸反应又能与氢氧化钠溶液反应的是
| A.AlCl3 | B.Al(OH)3 | C.KOH | D.HCl |
下列离子方程式书写正确的是
| A.钠和冷水反应: Na + H2O = Na++OH一+H2↑ |
| B.铁粉投入到硫酸铜溶液中:Fe+Cu2+ =Fe2++Cu |
| C.AlCl3溶液中加入足量的氨水:Al3++3OH一= Al(OH)3↓ |
| D.氯化亚铁溶液中通入氯气:Fe2+ + Cl2=Fe3+ + 2Cl一 |
配制100mL 0.50 mol·L-1的 NaOH溶液,必须用到下列仪器中的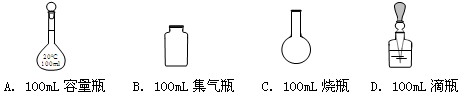
下列物质能用于制造光导纤维的是
| A.钢 | B.陶瓷 | C.聚乙烯 | D.二氧化硅 |