某澄清透明溶液中,可能大量存在下列离子中的若干种:H+、NH4+、K+、Mg2+、Cu2+、Br-、AlO2-、Cl-、SO42-、CO32-,现进行如下实验:
①用试管取少量溶液,逐滴加入稀盐酸至过量,溶液先浑浊后又变澄清,有无色气体放出。将溶液分为3份。
②在第1份溶液中逐滴加入NaOH溶液至过量,溶液先浑浊后又变澄清。加热,将湿润的红色石蕊试纸置于试管口,未见明显现象。
③在第2份溶液中加入新制的氯水和CCl4,振荡后静置,下层溶液显橙红色。
则下列推断正确的是:
A.溶液中一定有 、 、 、 、 、 、 |
B.溶液中一定没有 、 、 、 、 、 、 |
C.不能确定溶液中是否有 、 、 、 、 |
D.往第3份溶液中滴加BaCl2可确认是否有 |
下列有机化学反应方程式错误的是
A. |
B.CH3COOH + CH3CH2OH 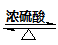 CH3COOCH2CH3 + H2O CH3COOCH2CH3 + H2O |
C.2CH3CH2OH + O2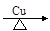 2CH3CHO + 2H2O 2CH3CHO + 2H2O |
D.n CH2=CH2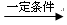 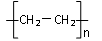 |
下列反应的离子方程式书写正确的是
| A.氯气被冷的氢氧化钠溶液吸收:Cl2+ 2OHˉ=Clˉ+ ClO2ˉ+ H2↑ |
| B.将二氧化碳通入稀碳酸钠溶液:CO2 + CO32ˉ+ H2O=2HCO3ˉ |
| C.硫酸铜溶液与氢氧化钡溶液反应:Ba2+ + SO42ˉ=Ba SO4↓ |
| D.二氧化氮气体溶于水:2NO2+H2O=2H++NO3ˉ+NO |
我国首创的海洋电池以铝板、铂网作电极,海水为电解质溶液,空气中的氧气与铝反应产生电流。电池总反应为:4Al+3O2+6H2O=4Al(OH)3,下列判断不正确的是
| A.电池工作时,电子由铝板沿导线流向铂网 |
| B.正极反应为:O2+H2O+2e-=2OH- |
| C.铂电极做成网状,可增大与氧气的接触面积 |
| D.该电池通常只需要更换铝板就可继续使用 |
用NA表示阿伏加德罗常数的值,下列说法中正确的是
| A.通常状况下,7.8gNa2O2固体中含离子总数为0.4NA |
| B.在常温常压下,11.2LO2所含有的原子数目为NA |
| C.1.2g镁在空气中完全燃烧失去的电子数为0.1NA |
| D.6g –CH3中含有的电子数为4NA |
下列实验方案能顺利达到实验目的的是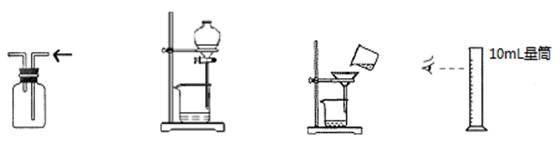
| A.排空气法收集NO | B.乙醇萃取碘水中碘 | C.过滤 | D.量取9.3mLH2O |