下图为常温下用0.1000mol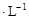 NaOH溶液滴定20.00mL 0.1000mol
NaOH溶液滴定20.00mL 0.1000mol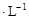 盐酸和20.00mL 0.1000mol
盐酸和20.00mL 0.1000mol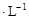 醋酸的曲线。若以HA表示酸,下列判断和说法正确的是
醋酸的曲线。若以HA表示酸,下列判断和说法正确的是
A.上左图是滴定盐酸的曲线
B.E点时溶液中离子浓度为c( )
) c(
c( )
)
C.B点时,反应消耗溶液体积:V(NaOH)<V(HA)
D.当0mL<V(NaOH) <20.00mL时,两溶液中各离子浓度大小顺序一定均为c( )>c(
)>c( )>c(
)>c(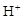 )>c(
)>c(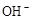 )
)
在273 K和101 kPa的条件下,将2.00 g氦气、1.40 g氮气和1.60 g氧气混合,该混合气体 的体积是
的体积是
| A.6.72 L | B.7.84 L | C.10.08 L | D.13.44 L |
同温同压下,在3支相同体积的试管中分别充有等体积混合的2种气体,它们是①NO和NO2,②NO2和O2,③NH3和N2。现将3支试管均倒置于水槽中,充分反应后,试管中剩余气体的体积分别为V1、V2、V3,则下列关系正确的是 A V1>V2>V3 B V1>V3>V2 C V2>V3>V1 D V3>V1>V2
A V1>V2>V3 B V1>V3>V2 C V2>V3>V1 D V3>V1>V2
镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生
 气体的体积(V)与时间(t)关系如右图。反应中镁和铝的
气体的体积(V)与时间(t)关系如右图。反应中镁和铝的


| A.物质的量之比为3:2 | B.质量之比为3:2  |
C.摩尔质量之比为2:3 | D.反应速率之比为2:3 |
用NA表示阿伏加德罗常数的值。下列叙述正确的是

A.25℃时,PH=13的1.0L Ba(OH)2溶液中含有的 数目为0.2NA 数目为0.2NA  |
B.标准状况下,2.24L Cl2与过量稀NaOH溶液反应,转移的电子总数为0.2NA  |
C.室温下,21.0g乙烯和丁烯的混合气体中含有的碳原子数目为1.5NA  |
D.标准状况下,22.4L甲醇中含有的氧原子数为1.0NA |
NA代表阿伏加德罗常数。下列有关叙述正确的是

A.标准状况下,2.24LH2O含有的分子数等于0.1NA  |
B.常温下, 溶液中阴离子总数大于0.1NA 溶液中阴离子总数大于0.1NA  |
C.分子数为NA的CO、C2H4混合气体体积约为22.4L,质量为28g  |
D.3.4 中含N—H键数目为 中含N—H键数目为 |