(本题共9分)二烯烃是有机化工中的重要物质,分子中存在单双键交替出现的结构称为共轭结构,含共轭结构的多烯烃称为共轭烯烃。完成下列填空:
42.下列物质中含有共轭结构的是______。(填编号)
43.共轭二烯烃的加成位置有多种可能,天然橡胶的单体与溴反应的产物可能有_______种。
44.共轭二烯及其衍生物可以与含碳碳双键、叁键的化合物进行加成。例如:
则要制备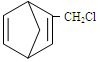 ,含共轭结构的原料可以是___________。(写结构简式)
,含共轭结构的原料可以是___________。(写结构简式)
45.设计一条从1,3-丁二烯合成阻燃剂  的合成路线(其他无机试剂任选)。
的合成路线(其他无机试剂任选)。
(合成路线常用的表示方式为: )
)
_________________________________________________________________________
当今世界,能源的发展日益成为全世界、全人类共同关心的问题。
(1)A和B的单质单位质量的燃烧热大,可用作燃料。已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:
| 电离能(kJ/mol) |
I1 |
I2 |
I3 |
I4 |
| A |
899 |
1 757 |
14 840 |
21 000 |
| B |
738 |
1 451 |
7 733 |
10 540 |
①请根据上述信息,写出A的核外电子排布式:__________________。
②某同学根据上述信息,推断B的核外电子排布如图1所示,该同学所画的电子排布图违背了________。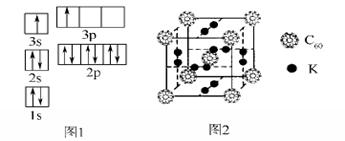
(2)氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料。
①已知金刚石中碳碳键的键长为154.45 pm,C60中碳碳键的键长为145 pm和140 pm,有同学据此认为C60的熔点高于金刚石,你认为是否正确并阐述理由,理由:_____________________。
②科学家把C60和K掺杂在一起制造了一种富勒烯化合物,其晶胞如图2所示,该物质在低温时是一种超导体。该物质中K原子和C60分子的个数比为____________。
③继C60后,科学家又合成Si60、N60,请比较C、Si、N原子电负性由大到小的顺序。Si60分子中每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,则一个Si60分子中所含π键的数目为__________。
(1)通常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。
| 化学键 |
Si—O |
Si—Cl |
H—H |
H—Cl |
Si—Si |
Si—C |
| 键能/kJ·mol—1 |
460 |
360 |
436 |
431 |
176 |
347 |
请回答下列问题:
①比较下列两组物质的熔点高低(填“>”或“<”=)
SiCSi; SiCl4SiO2
②下图立方体中心的“●”表示硅晶体中的一个原子,请在立方体的顶点用“●”表示出与之紧邻的硅原子。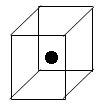
③工业上高纯硅可通过下列反应制取:
SiCl4(g) + 2H2(g) 高温Si(s) + 4 HCl(g)该反应的反应热△H =kJ/mol.
(2)化合物Na2O的晶胞如图。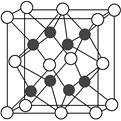
①其中O2-离子的配位数为________,
②该化合物与MgO相比,熔点较高的是________(填化学式)。
③已知该化合物的晶胞边长为a pm,则该化合物的密度为________g·cm-3(只要求列出算式,不必计算出数值,阿伏加德罗常数的数值为NA)。
(1)自从1962年首次合成了第一个稀有气体的化合物XePtF6以来,人们又相继发现了氙气的一系列化合物如XeF2、XeF4等。巴特列为开拓稀有气体化学作出了历史性贡献。
①请根据XeF4的结构示意图(图1)判断这个分子是(填极性分子或非极性分子)。
②XeF2晶体是一种无色晶体,图2为它的晶胞结构图。XeF2晶体属于哪种类型的晶体__________;
③一个XeF2晶胞中实际拥有XeF2_______个。
(2)新制备的Cu(OH)2可将乙醛(CH3CHO)氧化成乙酸,而自身还原成Cu2O。乙醛中碳原子的杂化轨道类型为,1 mol乙醛分子中含有的σ键的数目为。乙酸的沸点明显高于乙醛,其主要原因是。Cu2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和顶点,则该晶胞中有个铜原子。
Ⅰ.(1)人们把拆开1 mol化学键所吸收的能量看成该化学键的键能。
已知N2、O2分子中化学键的键能分别是946 kJ·mol-1、497 kJ·mol-1。
查阅资料获知如下反应的热化学方程式。
N2(g)+O2(g)==="2NO(g)" ΔH=+180 kJ·mol-1;
N2(g)+2O2(g)===2NO2(g)ΔH=+68 kJ·mol-1;
2C(s)+O2 (g)===2CO(g)ΔH=-221 kJ·mol-1;
C(s)+O2(g)===CO2(g)ΔH=-393.5 kJ·mol-1。
①一定条件下,N2与O2反应生成NO能够自发进行,其原因是___,NO分子中化学键的键能为___kJ·mol-1。
②CO与NO2反应的热化学方程式为4CO(g)+2NO2(g)===4CO2(g)+N2(g) ΔH=________。
Ⅱ.熔融状态下,钠的单质和FeCl2能组成可充电电池(装置示意图如下),反应原理为:
2Na+FeCl2 Fe+2NaCl
Fe+2NaCl
放电时,电池的正极反应式为________________;充电时,________(写物质名称)电极接电源的负极;该电池的电解质为______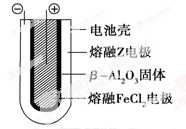
(4分)核磁共振谱是测定有机物分子结构最有用的工具之一。瑞士科学家维特里希等三人即是利用核磁共振技术测定生物大分子的三维结构而获得2002年诺贝尔化学奖。在有机物分子中,不同位置的氢原子在质子核磁共振谱(PMR)中给出的峰值(信号)也不同,根据峰(信号)可以确定有机物分子中氢原子的种类和数目。例如:乙醛的结构式为 ,其PMR谱中有2个信号峰,其强度之比为3∶1。
,其PMR谱中有2个信号峰,其强度之比为3∶1。
(1)下列有机物分子中,在质子核磁共振谱中只给出一种峰(信号)的是________。
| A.CH3—CH3 | B.CH3CHO |
| C.CH3CH2OCH2CH3 | D.CH3COCH3 |
(2)化合物A和B的分子式都是C2H4Br2,A的PMR谱上只有1个峰,则A的结构简式为___________。B的PMR谱上有__________________个峰,强度比为________________。