[选修3-物质结构与性质]
Ⅰ下列物质的结构或性质与氢键无关的是
Ⅱ钒()是我国的丰产元素,广泛用于催化及钢铁工业。
回答下列问题:
(1)钒在元素周期表中的位置为
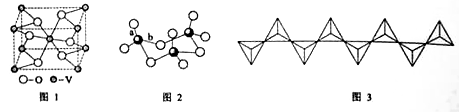
(2) 钒的某种氧化物的晶胞结构如图1所示。晶胞中实际拥有的阴、阳离子个数分别为
(3)常用作转化为的催化剂。分子中原子价层电子对数是
(4)溶解在溶液中,可得到钒酸钠(),该盐阴离子的立体构型为
现有A、B、C、D、E五种原子序数依次增加的短周期元素,其中A的最低负价和最高正价代数和为零,且A2常温下为气态,B与其他元素形成的化合物种类最多,C与E可形成EC2和EC3两种物质,D是短周期最活泼的金属元素,用化学用语回答下列问题:
(1)D离子结构示意图_________________,B在元素周期表的位置_______________;
(2)A与C形成含18个电子的化合物的电子式是_______________;
(3)C与D形成的一种化合物颜色为淡黄色,其阴阳离子个数比为_____________,含有的化学键类型为___________;
(4)C、D、E的常见离子的离子半径由大到小的顺序__________________;
(5)B、E两元素得电子能力B________E(填“>”或“<”),试写出证明该结论的一个化学方程式_______;
(6)工业上常用氨水吸收尾气中的EC2,离子方程式为_______________________。
有A、B、C、D、E 五种元素,它们的核电荷数依次增大,且都小于20。其中C、E是金属元素;A和E属同一族,它们原子的最外层电子排布为ns1。B和D也属同一族,它们原子最外层的p能级电子数是s能级电子数的两倍,C原子最外层上电子数等于D原子最外层上电子数的一半。请回答下列问题:
(1)以上这五种元素中,属于S区的是____________________(填元素符号)。
(2)C、D、E四种元素的简单离子按半径由小到大的顺序为(用离子符号表示)____________。
(3)写出D元素基态原子的外围电子排布式__________________________________。
(4)元素电负性为B___________D,元素第一电离能为C__________E。(填“﹥”、“﹤”或“﹦”)
(5)由这五种元素组成的一种化合物是____________________(写化学式)。[来
A、B、C是三种常见的化合物,A为淡黄色固体。它们之间的转化关系如图所示。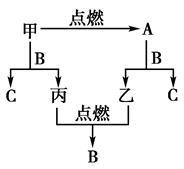
(1)A的名称 ;
(2)若取甲和A的混合物12.4g与足量的B反应后,生成的丙和乙恰好完全反应,且所得C溶液的体积为100mL,所得C溶液的物质的量浓度为: 。
(3)甲与B反应的离子反应方程式 ,
A和CO2反应的方程式: ,
C和Al反应的离子方程式: 。
有三种金属单质A、B、C,其中A的焰色反应为黄色,B、C是常见金属。三种金属单质A、B、C能与气体甲、乙、丙及物质D、E、F、G、H之间发生如下转化关系(图中有些反应的产物和反应的条件没有标出)。
请根据以上信息回答下列问题: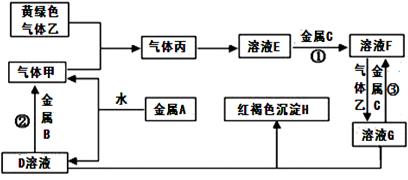
(1)写出下列物质的化学式:乙 、H ;
(2)写出反应②的离子方程式: ;
(3)写出金属A与水反应的离子方程式 ;
(4)F与D溶液反应后的产物在空气中转化为H的化学方程式 ;现象为 。
用CO2 和环氧化物共聚合成全降解二氧化碳基塑料,既可有效解决CO2过量排放引起的温室效应、又可除去白色污染。已知该反应为: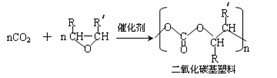
(-R、-R'代表烃基或氢原子)
(1)该反应为 反应。
(2)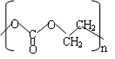 的单体是 。
的单体是 。
通过下列途径既可以得到全降解二氧化碳基塑料还可得到用途广泛的高分子化合物PA66。
已知: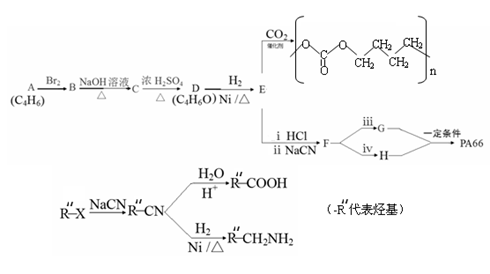
(3)A、B、C分子均为直链结构,且A、B的核磁共振氢谱都只有两个峰,峰面积之比为1:2,则
①A的结构简式是____________,名称是 。
②B是顺式结构, B→C的化学方程式是 。
③由E制备二氧化碳基塑料的化学方程式是 。
(4)D的一种同分异构体在相同条件下也能制得E,其结构简式是 。
(5)已知1 molG可与NaHCO3溶液反应产生44.8LCO2(标准状态下),则
①1 mol E与2 mol HCl反应的化学方程式是 ___________________。
② G和H在一定条件下生成PA66的化学方程式是 。