食盐加碘是用来增加人体对碘的摄入量,防止缺碘引起的疾病.下表为某加碘盐的部分标签,根据所学知识回答下列问题:
| 加碘盐 |
| 质量等级:二级 碘含量:20~50mg/kg 配料:食盐、碘酸钾、抗结剂 储存方法:防潮、防热、避光 食用方法:在汤、菜即将煮好时再加入碘盐,确保碘效 保质期:12个月 |
(1)成年人缺碘会引起________.
(2)碘酸钾的化学式为KIO3,其中碘元素的化合价为________.
(3)从“储存方法”和“食用方法”推测,并参照下列溶解度,要从碘酸钾溶液中得到碘酸钾晶体,你建议的方法是________________________________________________.
| 温度/℃ |
0 |
10 |
20 |
40 |
60 |
80 |
| KIO3的溶解度/g |
4.60 |
6.27 |
8.08 |
12.6 |
18.3 |
24.8 |
(4)根据标签信息计算,加碘盐中碘酸钾的含量最多为________mg/kg(保留到小数点后一位).
(5)工业上生产碘酸钾的过程中,有一步反应是KH(IO3)2与KOH反应得到碘酸钾,该反应的化学方程式为________________________________________.
为测定空气中氧气的含量,小华同学打算设计如下图所示的实验方案: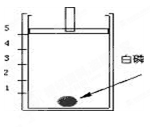
在一个隔热效果良好的容器上方安装一个可自由上下移动的活塞(活塞质量忽略不计,起始位置在5刻度处)。加热容器,使容器温度达到80℃(已知白磷燃烧所需的最低温度为40℃)。
请回答:
(1)实验过程中,可以观察到:白磷开始燃烧,产生大量;活塞先向移动,再向移动,最后停在刻度处。
(2)由此实验得出的结论_____________________________。
(3)有位同学用木炭取代白磷来进行实验,结果实验失败,请你分析实验失败的原因是__________________。
下图为某同学进行电解水实验的装置图,据此回答: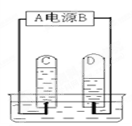
⑴图中A端为电源的___(填“正”或“负”)极。
⑵ D试管中收集到的气体是____,C、D试管中收集到的气体的体积比约为____。
⑶上述实验可以得出:水是由_________________组成的。
⑷在水的电解实验中,在变化前后没有改变的微粒是________。
(5分) ①将黑色粉末A和无色液体B混合,生成一种无色无味的气体C;②无色气体C能使带火星的木条复燃;③加热暗紫色固体D,可同时得到A、C和E。
试推断A、B、C、D、E 各是什么物质?
A是 B是 C是
D是 E是。
(4分)现有①氧气 ②自来水 ③铁粉 ④二氧化碳 ⑤氯酸钾 ⑥氮气 ⑦澄清的石灰水⑧空气 八种物质。
其中属于混合物的是(填序号,下同) ____________;属于单质的是________________;
属于化合物的是;属于氧化物的是____________。
(4分)阅读下面的短文,从中选择符合题意的句子填空(填序号):
①在通常状况下,氯气呈黄绿色,②有强烈的刺激性气味。③氯气在一个标准大气压下,冷却到-34.6℃时变成了液态氯,④继续冷却到-101℃时,变成了固态氯。⑤把氯气通入水中,部分氯气与水反应生成了盐酸和次氯酸。⑥红热的铜丝在氯气中会燃烧,⑦氢气也能在氯气中燃烧生成氯化氢气体。
以上句子中,属于描述物理变化的是,化学变化的是,
物理性质的是,化学性质的是。