(1)如图信息,瓶中溶液长期放置后溶质质量分数变小,是因为该物质具有 性。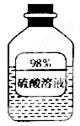
(2)某探究小组的同学对某工业废水(含有H2SO4、HNO3)中H2SO4的含量进行测定.取50g废水于烧杯中,加入足量BaCl2溶液、过滤、洗涤、干燥,得BaSO4固体11.65g.请解答下列问题:
①计算50g废水中H2SO4的溶质质量分数。(3分,要求写出计算过程)
②若改用KOH溶液(利用消耗的KOH的质量)测定50g废水中H2SO4的含量,结果可能会 ______(选填“偏低”、“偏高”或“不变”),原因是____________________。(每空1分,计2分)
金属在生产和生活中广泛的应用。
下列金属制品中,利用金属导电性的是____________(填字母序号);
铁制品在沙漠地区不易锈蚀的原因是_____________;
工业上用一氧化碳和赤铁矿炼铁反应的化学方程式为________________________;
某厂排放的废水中含有硫酸铜,将废水处理可得到铜和铁红(氧化铁)两种产品。过程如下图所示(废水中的其他物质不参与反应);
过程①中发生反应的化学方程式为_______________________________________;A—G七种物质中含铁元素的有___________(填字母代号)。
从微观的角度认识物质及其变化,更有助于了解物质组成及变化的本质。
上述粒子中,属于阴离子的有___________(填序号,下同);在化学反应中最易失去电子的是____________。
水是生命之源,右图是净化水的简易装置,请回答下列问题:
活性炭所起的作用是_____________;
检验该装置净化后的水是否为硬水可选择的试剂是____________;
电解一定质量的水,在负极上产生了10mL气体,则正极产生气体的体积为_______mL;
用化学用语按下列要求填空:
(1) 三个亚铁离子;
(2) 沼气的主要成分;
(3) 地壳中含量最多的金属元素______________。
在FeCl3溶液蚀刻铜箔制造电路板的工艺中,废液(主要含有FeCl2和CuCl2)处理和资源回收的工业流程如下: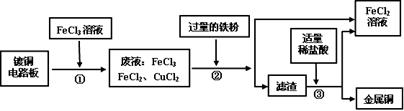
试回答下列问题:
(1)过程①中Cu和FeCl3反应的化学方程式:;过程②加入铁屑后发生的置换反应的化学方程式:;
(2)步骤②得到滤渣的成分是;步骤③的操作是过滤、、干燥等。
(3)Fe(OH)2与O2和H2O反应生成色Fe(OH)3。写出相关的化学方程式为:。