为探讨化学平衡移动原理与氧化还原反应规律的联系,某同学通过改变浓度研究
反应中
和
的相互转化。实验如下:

(1)待实验I溶液颜色不再改变时,再进行实验II,目的是使实验I的反应达到。
(2)iii是ii的对比试验,目的是排除有ii中造成的影响。
(3)i和ii的颜色变化表明平衡逆向移动,
向
转化。用化学平衡移动原理解释原因:。
(4)根据氧化还原反应的规律,该同学推测i中
向
转化的原因:外加
使
降低,导致
的还原性弱于
,用下图装置(a、b均为石墨电极)进行实验验证。

①
闭合时,指针向右偏转,b作极。
②当指针归零(反应达到平衡)后,向U型管左管滴加0.01
溶液,产生的现象证实了其推测,该现象是。
(5)按照(4)的原理,该同学用上图装置进行实验,证实了ii中
向
转化的原因,
①转化原因是。
②与(4)实验对比,不同的操作是。
(6)实验I中,还原性:
>
;而实验II中,还原性:
>
,将(3)和(4)、(5)作对比,得出的结论是
。
(8分)某一反应体系有反应物和生成物共五种物质:O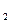 、H
、H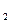 CrO
CrO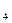 、Cr(OH)
、Cr(OH)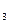 、H
、H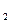 O、H
O、H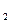 O
O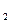 。已知该反应中H
。已知该反应中H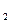 O
O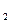 只发生如下过程:
只发生如下过程:
H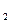 O
O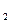
 O
O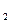
(1)该反应中的还原剂是____________________________________________________。
(2)该反应中,发生还原反应的过程是________________________________________。
(3)写出该反应的化学方程式,并标出电子转移的方向和数目____________________。
有一包白色固体粉末,其中可能含有NaCl、Ba(NO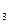 )
)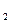 、CuSO
、CuSO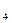 、Na
、Na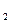 CO
CO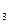 中的一种或几种,现做以下实验:
中的一种或几种,现做以下实验:
①将部分粉末加入水中,振荡,有白色沉淀生成,过滤,溶液呈无色。
②向①的沉淀物中加入足量稀硝酸,固体完全溶解,并有气泡产生。
③取少量②的溶液,滴入稀硫酸,有白色沉淀产生。
④另取①中过滤后的溶液加入足量AgNO 溶液,产生白色沉淀。
溶液,产生白色沉淀。
试根据上述实验事实,完成下列问题:
(1)原白色粉末中一定含有的物质是_____________,一定不含的物质是_______________,可能含有的物质是_________________。(以上各种物质均写化学式)
(2)写出各步变化可能的离子方程式。
镁和钙是第ⅡA族元素。
(1)镁和钙都能与水反应产生氢气,镁反应缓慢,钙则反应较快。请推测同主族的铍和钡与水反应的剧烈程度。
(2)钙在空气中会与氧气发生缓慢的反应,所以要把钙保存在密封的容器内。你认为钡应如何保存?
实验室用图2-16所示仪器和药品做CO2和Na2O2反应制O2的实验,试填写下列空白。
(1)装置②中所盛溶液最好选用____________。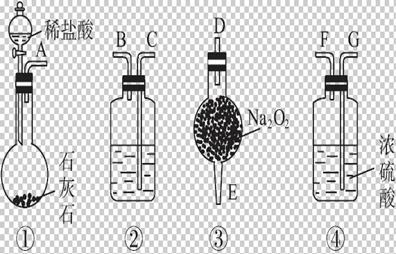
图2-16
A.饱和食盐水
B.饱和NaHCO3溶液
C.澄清石灰水
D.NaCl溶液
(2)如果将所制气体从左至右流向排列装置时,上述各仪器装置连接的正确顺序是(填写装置的编号)接接接,其中②③④之间的仪器接口按顺序应为(用接口标识A、B、C……填写)。
(3)装置②的作用是,发生反应的离子方程式是_______________。
某同学设计如下实验方案,并记录了有关实验现象,如下表。请你帮助该同学整理完成实验报告。
(1)实验目的:____________________________________________。
(2)实验用品:仪器________________________________________。
试剂________________________________________。
| 实验方案 |
实验现象 |
||||
| 1.用砂纸擦后的镁带与沸水反应,再向反应后溶液中滴加酚酞溶液 2.向新制的H2S饱和溶液中滴加新制的氯水 3.钠与滴有酚酞的冷水反应 4.镁带与2 mol·L-1盐酸反应 5.铝条与2 mol·L-1盐酸反应 6.向AlCl3溶液中滴加NaOH溶液至过量 |
E.生成白色胶状沉淀,继而沉淀消失 |
(3)实验内容:
| 实验方案* |
实验现象* |
有关化学方程式 |
(4)实验结论:_________________________________________________。
(5)问题讨论:①请从结构理论上简单说明上述结论的原因。
②请你补充一组实验方案(简单易行),证明此周期中另两种主族元素的性质递变规律。