七铝十二钙(12·7)是新型的超导材料和发光材料,用白云石(主要含和)和废片制备七铝十二钙的工艺如下:

(1)煅粉主要含和,用适量的溶液浸取煅粉后,镁化合物几乎不溶, 若溶液I中()小于5×10-6,则溶液大于(的=5×10-12);该工艺中不能用代替,原因是。
(2)滤液I中的阴离子有(忽略杂质成分的影响);若滤液I中仅通入,会生成,从而导致产率降低。
(3)用溶液可除去废片表面的氧化膜,反应的离子方程式为。
(4)电解制备时,电极分别为片和石墨,电解总反应方程式为。
(5)一种可超快充电的新型铝电池,充放电时和两种离子在电极上相互转化,其它离子不参与电极反应,放电时负极的电极反应式为。
依据事实,写出下列反应的热化学方程式
① 2molH2与2molI2蒸汽完全反应时,生成碘化氢气体,放出了29.8KJ的热量
______________________________________________________________
② 1克甲烷完全燃烧生成二氧化碳和液态水放出了aKJ的热,写出甲烷燃烧热的热化学方程式:
_____________________________________________________________
③ 12g镁在氧气中完全燃烧,生成氧化镁固体,放出247KJ的热量
①CaCO3 ="=" CaO + CO2;ΔH= +177.7kJ/mol
②C(s) + H2O(g)="=" CO(g) + H2(g);ΔH= -131.3kJ
③0.5H2SO4(l) + NaOH(l) ="=" 0.5Na2SO4(l) + H2O(l);ΔH=+57.3kJ/mol
④C(s) + O2(g) ="=" CO2(g);ΔH=-393.5kJ/mol
⑤CO(g) + 1/2 O2(g) ="=" CO2(g);ΔH=-283kJ/mol
⑥HNO3 (aq) + NaOH(aq) ="=" NaNO3(aq) + H2O(l);ΔH= -57.3kJ/mol
⑦2H2(g) + O2(g) ="=" 2H2O(l);ΔH= -517.6kJ/mol
(1)上述热化学方程式中,不正确的有()
(2)根据上述信息,写出C转化为CO的热化学方程式。
(3)上述反应中,表示燃烧热的热化学方程式有();表示中和热的热化学方程式有()。
(10分 )工业上用某矿渣(含有Cu2O、Al2O3、Fe2O3、SiO2)提取铜的操作流程如下: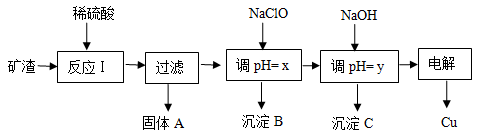
已知: Cu2O + 2H+=" Cu" + Cu2+ + H2O
| 沉淀物 |
Cu(OH)2 |
Al(OH)3 |
Fe(OH)3 |
Fe(OH)2 |
| 开始沉淀pH |
5.4 |
4.0 |
1.1 |
5.8 |
| 沉淀完全pH |
6.7 |
5.2 |
3.2 |
8.8 |
(1)反应I中如果Cu2O与Fe2O3之间恰好发生氧化还原反应,则反应的化学方程式为:___________________________________________________________________________
(2)用NaClO调pH=x是此工艺流程中的最佳选择。
①选择NaClO的理由是:____________________________________________________
②生成沉淀B的同时生成一种具有漂白作用的物质,写出该反应的离子方程式为:
_________________________________________________________________________
(3)如果某次测定pH=y的操作失误,将适量NaOH溶液滴加到0.02mol·L-1CuSO4溶液中,致使溶液中Cu2+浓度降至原来的百分之一,则溶液的pH为____。(已知常温下,Cu(OH)2的溶度积常数Ksp=2×10-20)
(4)电解初期阳极的电极反应式为________________________________
(18分)某校化学实验兴趣小组在“探究卤索单质的氧化性”的系列实验中发现:在足量的稀氯化亚铁溶液中,加入l~2滴溴水,振荡后溶液呈黄色。
提出问题Fe3+、Br2谁的氧化性更强?
(1)猜 想:①甲同学认为氧化性:Fe3+>Br2,故上述实验现象不是发生化学反应所致,则溶液呈黄色是含(填化学式,下同)所致。
②乙同学认为氧化性:Br2>Fe3+,故上述实验现象是发生化学反应所致,则溶液呈黄色是含所致。
(2)设计实验并验证
丙同学为验证乙同学的观点,选用下列某些试剂设计出两种方案进行实验,并通过观察实验现象,证明了乙同学的观点确实是正确的。
供选用的试剂:a.酚酞试液;b.CCl4;c.无水酒精;d.KSCN溶液。
请你在下表中写出丙同学选用的试剂及实验中观察到的现象。(试剂填序号)
| 选用试剂 |
实验现象 |
|
| 方案1 |
||
| 方案2 |
(3)结论:氧化性:Br2>Fe3+。故在足量的稀氯化亚铁溶液中,加入l~2滴溴水,溶液呈黄色所发生的离子反应方程式为。
(4)实验后的思考
①根据上述实验推测,若在溴化亚铁溶液中通入氯气,首先被氧化的离子是:
(填离子的化学式)。
②在100 mL FeBr2溶液中通入2.24 L Cl2(标准状况),溶液中有1/2的Br-被氧气成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为。
今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、Al3+、Fe3+、Mg2+、Ba2+、NH4+、Cl-、SO42-,现取三份100mL溶液进行如下实验:
①第一份溶液加入硝酸银溶液有沉淀生成
②第二份加入过量NaOH溶液加热后,只收集到气体0.02mol,无沉淀生成,同时得到溶液甲。
③在第二份所得的甲溶液中通入过量的CO2,生成白色沉淀,沉淀经过滤、洗涤、灼烧,质量为1.02g。
④第三份溶液加入足量BaCl2溶液后,得到白色沉淀,沉淀经足量盐酸洗涤、干燥后,质量为11.65g。
根据上述实验回答:
(1)一定不存在的离子是。
(2)试确定一定存在的阴离子及其浓度(可不填满)
离子符号,浓度。
离子符号,浓度。
(3)试确定K+是否存在(填“是”或“否”)理由是:。