及其盐都是重要的化工原料。
(1)用和制备,反应发生、气体收集和尾气处理装置依次为。

(2)按下图装置进行性质实验。

①先打开旋塞1,瓶中的现象是,原因是,稳定后,关闭旋塞1。
②再打开旋塞2,瓶中的现象是。
(3)设计实验,探究某一种因素对溶液中水解程度的影响。
限制试剂与仪器:固体、蒸馏水、100容量瓶、烧杯、胶头滴管、玻璃棒、药匙、天平、计、温度计、恒温水浴槽(可控制温度)
①实验目的:探究对溶液中水解程度的影响。
②设计实验方案,拟定实验表格,完整体现实验方案(列出能直接读取数据的相关物理量及需拟定的数据,数据用字母表示;表中(溶液)表示所配制溶液的体积)。
| 物理量 实验序号 |
(溶液)/ | …… |
|||
| 1 |
100 |
||||
| 2 |
100 |
③按实验序号I所拟数据进行实验,若读取的待测物理量的数值为,则水解反应得平衡转化率为(只列出算式,忽略水自身电离的影响)。
分)(用化学符号填空:
(1)①氯化亚铁中的阳离子 ;②标出碳酸钡中钡元素的化合价 ;③三个钙原子________。
(2)①SO3中“3”的含义: ;②Mg2+中“2”的含义: 。
(3)“候氏制碱法”中的创始人 。
如图所示的是初中化学中的一些重要实验。请回答下列问题: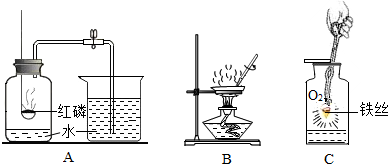
(1)实验A:测得空气中氧气体积分数小于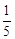 的原因可能是(只答一条): 。
的原因可能是(只答一条): 。
(2)实验B:用玻璃棒搅拌的目的是 。
(3)实验C:集气瓶内放少量水的目的是 。
在具有活塞的密闭容器中,一定温度下的可逆反应,H2(g)+I2(g)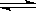 2HI(g)已达平衡,将活塞外拉,在此过程中:
2HI(g)已达平衡,将活塞外拉,在此过程中:
(1)容器颜色 (填“变浅”或“变深”)
(2)容器内的压强 (填“变大”“变小”或“不变”)
(3)混合气体的密度 (填“变大”“变小”或“不变”
某密闭容器中,有A、B两种气体,反应按下式进行A(g)+B(g)=2C(g)反应经过2s后浓度不再发生变化时,测得容器中各物质的浓度分别为c(A)=0.5mol/L,c(B)=0.75 mol/L,c(C)=0.5 mol/L。
(1)B物质的起始浓度各为
(2)2s时A的转化率
(3)用物质A表示反应的平均速率
已知下热化学方程式:
①H2(g)+1/2O2(g)= H2O(l) ⊿H= —285.8 kJ/mol
②H2(g)+1/2O2(g)= H2O(g) ⊿H= —241.8kJ/mol
③C(s)+1/2O2(g) =" CO" (g) ⊿H= —110.5kJ/mol
④C(s)+ O2(g) = CO2(g) ⊿H= —393.5kJ/mol
回答下列问题:
(1)上述反应中属于放热的是
(2)H2的燃烧热为 ,C的燃烧热为
(3)燃烧10g H2生成液态水,放出的热量为
(4)CO的燃烧热为 ,其热化学方程式为