室温下,向下列溶液中通入相应的气体至溶液pH=7(通入气体对溶液体积的影响可忽略),溶液中部分微粒的物质的量浓度关系正确的是
| A.向0.10mol·L-1NH4HCO3溶液中通入CO2:c(NH4+)=c(HCO3-)+c(CO32-) |
| B.向0.10mol·L-1NaHSO3溶液中通入NH3:c(Na+)>c(NH4+)>c(SO32-) |
| C.0.10mol·L-1Na2SO3溶液通入SO2:c(Na+)=2[c(SO32-)+c(HSO3-)+c(H2SO3)] |
| D.0.10mol·L-1CH3COONa溶液中通入HCl:c(Na+)>c(CH3COOH)=c(Cl-) |
我国是稀土资源丰富的国家之一。已知 与
与 是稀土元素,下列有关说法不正确的是
是稀土元素,下列有关说法不正确的是
A. 与 与 互为同位素 互为同位素 |
B. 与 与 的的化学性质相同 的的化学性质相同 |
C. 与 与 是不同的核素 是不同的核素 |
D. 与 与 的核外电子数和中子数均为62 的核外电子数和中子数均为62 |
(普通班做)现有反应:CO(g)+ H2O(g)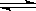 CO2(g)+ H2(g) △H﹤0,在850℃时,平衡常数K=1,现在850℃下,向2L的密闭容器中充入CO、H2O(g)各4mol,回答下列问题:
CO2(g)+ H2(g) △H﹤0,在850℃时,平衡常数K=1,现在850℃下,向2L的密闭容器中充入CO、H2O(g)各4mol,回答下列问题:
(1)当CO转化率为25%时,该反应是否达平衡,向哪个方向进行?
(2)达平衡时,CO转化率为多少?
(3)平衡时,H2的体积分数为多少?
(4)平衡时,混合气体的平均相对分子质量为多少?
已知H2、CH4的燃烧热分别为286KJ/mol、890KJ/mol。实验测得氢气和甲烷的混和气体共1mol完全燃烧时放热588kJ,则混和气体中氢气与甲烷的体积比约为
| A.3:1 | B.2:1 | C.1:1 | D.1:2 |
已知:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-49.0kJ·mol-1一定条件下,向体积为1L的密闭容器中充入lmolCO2和3mo1H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如图所示。下列叙述中正确的是
CH3OH(g)+H2O(g) △H=-49.0kJ·mol-1一定条件下,向体积为1L的密闭容器中充入lmolCO2和3mo1H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如图所示。下列叙述中正确的是
| A.升高温度平衡常数K增大 |
| B.反应达到平衡状态时,CO2的平衡转化率为75% |
| C.3min时,用CO2的浓度表示的正反应速率等于用CH3OH的浓度表示的逆反应速率 |
| D.从反应开始到平衡,H2的平均反应速率v(H2)=0.075 mol·L-1·min-1 |
在一体积可变的密闭容器中,加入一定量的X、Y,发生反应mX(g) nY(g) ΔH=Q kJ/mol。反应达到平衡时,Y的物质的量浓度与温度、气体体积的关系如下表所示:下列说法正确的是
nY(g) ΔH=Q kJ/mol。反应达到平衡时,Y的物质的量浓度与温度、气体体积的关系如下表所示:下列说法正确的是
| /L积体气温体c(Y)/mol•L-1度/℃ |
1 |
2 |
3 |
| 100 |
1.00 |
0.75 |
0.53 |
| 200 |
1.20 |
0.90 |
0.63 |
| 300 |
1.30 |
1.00 |
0.70 |
A.m > n
B.Q < 0
C.温度不变,压强增大,Y的质量分数减少
D.体积不变,温度升高,平衡向逆反应方向移动