黑火药是中国古代的四大发明之一,其爆炸的热化学方程式为:
已知硫的燃烧热
则x为
室温下,下列各组离子、分子在指定溶液中一定能大量共存的是
| A.Na2S溶液中 SO42-、 K+、Br-、Cu2+ |
| B.在c(H+)=1.0×10-13mol·L-1的溶液中 Na+、S2-、AlO2-、SO32- |
| C.能使甲基橙显红色的溶液: K+、MnO4-、H2C2O4、SO42- |
| D.在 NH3·H2O 的溶液中Ba2+、NO3-、Cl-、Ag+ |
下列有关实验的叙述正确的是
| A.用水润湿的pH试纸来测量溶液的pH |
| B.实验室需要480 mL 2.0 mol·L-1的氢氧化钠溶液,配制该溶液时先称量氢氧化钠固体38.4 g,然后再按照溶解、冷却、移液、洗涤、定容、摇匀的步骤进行操作 |
| C.用溴水、淀粉-KI溶液比较Br2与I2的氧化性强弱,所需玻璃仪器主要有:试管、胶头滴管 |
| D.向溶液中滴加硝酸酸化的Ba(NO3)2溶液出现白色沉淀,说明该溶液中一定有SO42- |
已知P单质在KOH溶液中的变化是:4P+3KOH+3H2O=3KH2PO2+PH3↑,下列说法正确的是
| A.产物PH3分子中所有的原子可能共平面 |
| B.该反应中P做还原剂,H2O做氧化剂 |
| C.相关元素的第一电离能的大小顺序:S>P>Si |
| D.该反应每发生0.3摩尔电子转移,PH3分子中就有0.3摩尔P-H键形成 |
将20mL 0.1 mol·L-1的氨水与l0mL 0.1 mol·L-1的盐酸混合,在所得到的溶液中离子浓度的关系错误的是()
| A.c(NH4+)+c(H+)=c(OH-)+c(Cl-) |
| B.c(NH4+)+c(NH3·H2O)=2c(Cl-) |
| C.2c(OH-)—2c(H+)=c(NH4+)—c(NH3·H2O) |
| D.c(H+)=c(NH3·H2O)+c(OH-) |
由于具有超低耗电量、寿命长的特点,LED产品越来越受人欢迎。下图是氢氧燃料电池驱动LED发光的装置。下列有关叙述正确的是()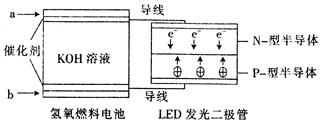
| A.a处通人氧气,b处通人氢气 |
| B.该装置中只涉及两种形式的能量转化 |
| C.电池正极电极反应式为O2+2H2O+4e-﹦4OH- |
| D.P一型半导体连接的是电池负极 |