如图X、Y、A、B、C均为短周期主族元素,其中只有一种是金属元素,则下列说法错误是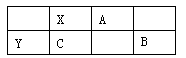
A.原子半径大小:Y > C > X > A
B.Y和B形成的化合物中Y和B的原子个数比为2:3
C.X、C、A中最高价氧化物对应的水化物的酸性最强的是A
D.A、B均为非金属元素,所以两者的氢化物相遇不发生反应
W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,W的气态氢化物可与其最高价含氧酸反应生成离子化合物,下列说法正确的是
| W |
X |
|
| Y |
Z |
A.四种元素中最简单氢化物稳定性最强的是Y
B.Z元素最高价氧化物对应水化物的酸性一定强于Y
C.X与Y元素的化合价完全相同
D.Z元素单质在化学反应中只表现氧化性
化学无处不在,与化学有关的说法不正确的是
| A.工业制碱用食盐和二氧化碳、氨气反应生产碳酸氢钠应用了物质溶解度的差异 |
| B.可用蘸浓盐酸的棉棒检验输送氨气的管道是否漏气 |
| C.黑火药由硫磺、硝石、木炭三种物质按一定比例混合制成 |
| D.碘是人体必需微量元素,所以要多吃富含高碘酸的食物 |
下列金属防腐的措施中,属于使用电化学保护法的是
| A.在铁中加入铬、镍等制成不锈钢 | B.金属护栏表面涂漆 |
| C.汽车底盘喷涂高分子膜 | D.地下钢管连接镁块 |
在水溶液中能大量共存的一组离子是
| A.Na+、Al3+、Cl-、CO32- | B.K+、NH4+、OH-、SO42 |
| C.Na+、Ba2+、Cl—、NO3— | D.H+、Na+、Fe2+、MnO4- |
下列表示对应化学反应的离子方程式正确的是
| A.碳酸氢钠溶液中滴入氢氧化钙溶液:HCO3-+OH–= CO32-+ H2O |
| B.向NH4HCO3溶液中加过量NaOH溶液并加热:NH4++OH-= NH3↑+H2O |
| C.将过量二氧化硫气体入冷氨水中:SO2+NH3·H2O=HSO3-+NH4+ |
| D.硅酸钠溶液与醋酸溶液混合:SiO32-+2H+=H2SiO3↓ |