(17分)工业上煅烧黄铜矿(CuFeS2)冶炼铜并得到碱式硫酸铁[Fe(OH)SO4]等其他重要化合物,主要流程如下(部分反应物和产物未标出):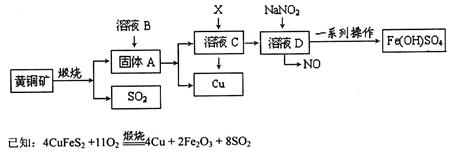
(1)溶液B是_____________________;X是__________________________________。
(2)某同学取溶液C滴入KSCN溶液,溶液不变红,说明溶液C中不含Fe3+,其原因是________(用简单的文字和离子方程式说明):再向该溶液中滴入H2O2溶液,溶液变红色。则滴入H2O2溶液发生反应的离子方程式为___________________。
(3)在溶液D与NaNO2的反应中,常采用同时通入O2以减少NaNO2的用量,O2与NaNO2在反应中均作____________,如参加反应的O2有11.2L(标况),则相当于节约NaNO2物质的量为______________mol。
(4)该法得到的金属铜中常含有金、银、铁、镍等金属杂质,常用电解精炼的方法得到纯铜,请在右边框内画出其原理装置示意图。
(5)[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂,它溶于水后产生的Fe(OH)2+离子,可部分水解生成Fe2(OH)42+聚合离子。该水解反应的离子方程式为____________。
物质A~G有下图所示转化关系(部分反应物、生成物没有列出)。其中A为某金属矿的主要成分,经过一系列反应可得到B和C。单质C可与E的浓溶液发生反应,G为砖红色沉淀。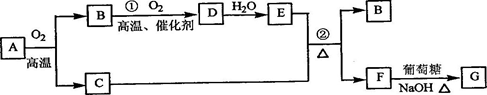
请回答下列问题:
(1)写出下列物质的化学式:B 、E 、G ;
(2)利用电解可提纯C物质,在该电解反应中阳极物质是 ,阴极物质是 ,电解质溶液是 ;
(3)反应②的化学方程式是 。
(4)将0.23 mol B和0.11 mol氧气放入容积为1 L的密闭容器中,发生反应①,在一定温度下,反应达到平衡,得到0.12 mol D,则反应的平衡常数K= 。若温度不变,再加入0.50 mol氧气后重新达到平衡,则B的平衡浓度 (填“增大”、“不变”或“减小”),氧气的转化率 (填“升高”、“不变”或“降低”),D的体积分数 (填“增大”、“不变”或“减小”)。
[实验化学]磷酸铁(FePO4·2H2O,难溶于水的米白色固体)可用于生成药物、食品添加剂和锂离子电池的正极材料,实验室可通过下列实验制备磷酸铁。
(1)称取一定量已除去油污的废铁屑,加入稍过量的稀硫酸,加热、搅拌,反应一段时间后过滤,反应加热的目的是 。
(2)向滤液中加入一定量H2O2氧化Fe2+。为确定加入H2O2的量,需先用K2Cr2O7标准溶液滴定滤液中的Fe2+,离子方程式如下:
①在向滴定管注入K2Cr2O7标准溶液前,滴定管需要检漏、 和 。
②若滴定xmL滤液中的Fe2+,消耗amol·L—1 K2Cr2O7标准溶液bmL,则滤液中c(Fe2+)= mol·L—1
③为使滤液中的Fe2+完全被H2O2氧化,下列实验条件控制正确的是 (填序号)。
| A.加入适当过量的H2O2溶液 |
| B.缓慢滴加H2O2溶液并搅拌 |
| C.加热,使反应在较高温度下进行 |
| D.用氨水调节pH=7 |
(3)将一定量的Na2HPO4溶液(溶液显碱性)加入到含有Fe3+的溶液中,搅拌、过滤、洗涤、干燥得到FePO4·2H2O。若反应得到的FePO4·2H2O固体呈棕黄色,则磷酸铁中混有的杂质可能为 。
某研究小组利用下图装置探究温度对CO还原Fe2O3的影响(固定装置略)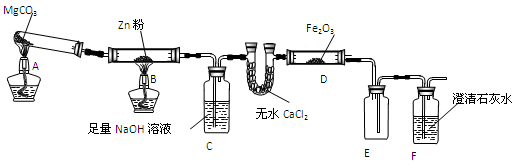
(1)MgCO3的分解产物为 。
(2)装置C的作用是 ,处理尾气的方法为 。
(3)将研究小组分为两组,按图装置进行对比实验,甲组用酒精灯、乙组用酒精喷灯对装置D加热,反应产物均为黑色粉末(纯净物),两组分别用产物进行以下实验。
| 步骤 |
操作 |
甲组现象 |
乙组现象 |
| 1 |
取黑色粉末加入稀盐酸 |
溶解,无气泡 |
溶解,有气泡 |
| 2 |
取步骤1中溶液,滴加K3[Fe(CN)6]溶液 |
蓝色沉淀 |
蓝色沉淀 |
| 3 |
取步骤1中溶液,滴加KSCN溶液 |
变红 |
无现象 |
| 4 |
向步骤3溶液中滴加新制氯水 |
红色褪去 |
先变红,后褪色 |
①乙组得到的黑色粉末是 ;
②甲组步骤1中反应的离子方程式为 ;
③乙组步骤4中,溶液变红的原因为 ;溶液褪色可能的原因及其验证方法为 ;
④从实验安全考虑,题9图装置还可采取的改进措施是 。
柠檬酸亚铁(FeC6H6O7)是一种易吸收的高效铁制剂,可由绿矾(FeSO4·7H2O)通过下列反应制备:FeSO4+Na2CO3="==" FeCO3↓+Na2SO4FeCO3+C6H8O7="==" FeC6H6O7+CO2↑+H2O 下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
| 金属离子 |
开始沉淀的pH |
沉淀完全的pH |
| Fe3+ |
1. 1 |
3. 2 |
| Al3+ |
3. 0 |
5. 0 |
| Fe2+ |
5. 8 |
8. 8 |
(1)制备FeCO3时,选用的加料方式是 (填字母),原因是 。
a.将FeSO4溶液与Na2CO3溶液同时加入到反应容器中
b.将FeSO4溶液缓慢加入到盛有Na2CO3溶液的反应容器中
c.将Na2CO3溶液缓慢加入到盛有FeSO4溶液的反应容器中
(2)生成的FeCO3沉淀需经充分洗涤,检验洗涤是否完全的方法是 。
(3)将制得的FeCO3加入到足量柠檬酸溶液中,再加入少量铁粉,80℃下搅拌反应。①铁粉的作用是 。②反应结束后,无需过滤,除去过量铁粉的方法是 。
(4)最后溶液经浓缩、加入适量无水乙醇、静置、过滤、洗涤、干燥,获得柠檬酸亚铁晶体。分离过程中加入无水乙醇的目的是 。
(5)某研究性学习小组欲从硫铁矿烧渣(主要成分为Fe2O3、SiO2、Al2O3)出发,先制备绿矾,再合成柠檬酸亚铁。请结合下图的绿矾溶解度曲线,补充完整由硫铁矿烧渣制备FeSO4·7H2O晶体的实验步骤(可选用的试剂:铁粉、稀硫酸和NaOH溶液):向一定量烧渣中加入足量的稀硫酸充分反应, ,得到FeSO4溶液, ,得到FeSO4·7H2O晶体。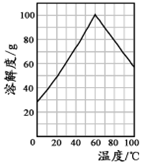
铁是应用最广泛的金属,铁的卤化物、氧化物以及高价铁的含氧酸盐均为重要化合物。
(1)要确定铁的某氯化物FeClx的化学式,可用离子交换和滴定的方法。实验中称取0.54g的FeClx样品,溶解后先进行阳离子交换预处理,再通过含有饱和OH-的阴离子交换柱,使Cl-和OH-发生交换。交换完成后,流出溶液的OH-用0.40mol.L-1的盐酸滴定,滴至终点时消耗盐酸25.0mL。计算该样品中氯的物质的量,并求出FeClx中x值:
(列出计算过程);
(2)现有一含有FeCl2和FeCl3的混合物样品,采用上述方法测得n(Fe):n(Cl)=1:2.1,则该样品中FeCl3的物质的量分数为 。在实验室中,FeCl2可用铁粉和 盐酸反应制备,FeCl3可用铁粉
和 反应制备;
(3)FeCl3与氢碘酸反应时可生成棕色物质,该反应的离子方程式为
(4)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。FeCl3与KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为
与MnO2-Zn电池类似,K2FeO4-Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,其电极反应式为 ,该电池总反应的离子方程式为 。