部分弱电解质的电离平衡常数如下表,以下选项错误的是
| 化学式 |
NH3·H2O |
CH3COOH |
HCN |
H2CO3 |
| Ki(25℃) |
1.8×l0—5 |
1.8×l0—5 |
4.9×l0—10 |
Ki1= 4.3×l0—7 Ki2= 5.6×l0—11 |
A.等物质的量浓度的NaHCO3和NaCN溶液,前者溶液中水的电离程度大
B.0.1 mol/L CH3COONa 溶液显碱性,0.1 mol/L CH3COONH4溶液显中性
C.CN-+H2O+CO2→HCN+ HCO3-
D.中和等体积、等pH的CH3COOH和HCN消耗NaOH的量前者小于后者
甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如下转化关系: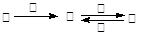 。下列有关物质的推断不正确的是
。下列有关物质的推断不正确的是
| A.若甲为焦炭,则丁可能是O2 |
| B.若甲为SO2,则丁可能是氨水 |
| C.若甲为Fe,则丁可能是盐酸 |
| D.若甲为NaOH溶液,则丁可能是CO2 |
在AlCl 和FeCl
和FeCl 混合溶液中,先加入过量的KI溶液,再加入足量的Na
混合溶液中,先加入过量的KI溶液,再加入足量的Na S溶液,所得 到的沉淀物是
S溶液,所得 到的沉淀物是
A.Fe(OH) 、Al(OH) 、Al(OH) |
B.Al(OH) 、I 、I |
C.Fe S S 、I 、I |
D.FeS、S、Al(OH) |
下列有关热化学方程式的叙述正确的是
| A.已知2H2O(g) =2H2(g)+O2(g) △H=+483.6 kJ/mol,则氢气的燃烧热为△H=-241.8kJ/mol |
| B.已知C(石墨,s)= C(金刚石,s)△H>0,则金刚石不如石墨稳定 |
| C.已知中和热为△H=-57.4kJ/mol,则稀醋酸和稀NaOH溶液反应的热化学方程式为:NaOH(aq)+CH3COOH(aq)=CH3COONa(aq)+H2O(l) △H=-57.4kJ/mol |
| D.已知2C(s)+2O2(g)=2CO2 (g) △H1;2C(s)+O2 (g)=2CO(g) △H2,则△H1>△H2 |
下列说法正确的是
| A.NaHCO3溶液和NaAlO2溶液混合会放出CO2 |
| B.向沸水中逐滴加入少量饱和FeCl3溶液,可制得Fe(OH)3胶体 |
| C.能使润湿的淀粉KI试纸变成蓝色的物质一定是Cl2 |
| D.AlCl3溶液和NaAlO2溶液加热蒸干、灼烧都得到Al2O3 |
下列离子方程式不正确的是
A.用铜电极电解NaCl溶液:2 Cl-+2H2O  Cl2↑+H2↑+2 OH- Cl2↑+H2↑+2 OH- |
| B.氢氧化铁溶于氢碘酸中:2Fe(OH)3+6H++2I-=2Fe2++I2+6H2O |
| C.漂白粉溶液中加氯化铁溶液产生大量红褐色沉淀:Fe3++3ClO-+3H2O=Fe(OH)3↓+3HClO |
| D.Cl2通入FeBr2溶液中,Cl2与FeBr2物质的量之比4︰5:10Fe2++6Br-+8Cl2=10Fe3++3Br2+16Cl- |