在实验室中,用下图所示装置(尾气处理装置略去)进行下列实验,将①中液体逐滴滴入到②中。实验结果与预测的现象一致的是
| 选项 |
①中的物质 |
②中的物质 |
预测②中的现象 |
| A. |
氢氧化钠 |
明矾溶液 |
开始时即产生白色沉淀 |
| B. |
浓硫酸 |
铜片 |
产生无色气体,溶液变蓝 |
| C. |
浓硝酸 |
用砂纸打磨过的铝条 |
产生红棕色气体 |
| D. |
稀盐酸 |
碳酸钠与氢氧化钠的混合溶液 |
开始时无明显现象 |
取5mL 18mol/L的浓硫酸与足量的铜加热充分反应,等反应结束,收集到的是( )
| A.0.09mol的H2 | B.0.09mol的SO2 |
| C.小于0.045mol的SO2 | D.0.045mol的SO2 |
将铁粉、铜粉混合物加入FeC13溶液,充分反应后仍有固体存在,则
下列判断不正确的是 ( )
| A.加入KSCN溶液一定不变红色 | B.溶液中一定含Fe2+ |
| C.溶液中一定不含Cu2+ | D.剩余固体中一定含Cu |
两瓶均为棕黄色的氯化铁溶液和溴水,用下列试剂无法鉴别的是( )
| A.KSCN | B.CCl4 | C.NaOH | D.淀粉KI试纸 |
学生设计了如图的方法对A盐进行鉴定: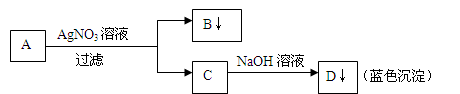
由此分析,下列结论中,正确的是( )
| A.A中一定有Fe3+ | B.C中一定有Cu2+ |
| C.B一定为AgBr沉淀 | D.A一定为CuCl2溶液 |
下列离子方程式书写正确的是( )
| A.氯气通入冷的氢氧化钠溶液中: Cl2 + 2OH-=Cl- + ClO- + H2O |
| B.铁粉与稀硫酸反应:2Fe+6H+=2Fe3++3H2↑ |
| C.氢氧化钡溶液与稀硫酸反应:Ba2++SO42-=BaSO4↓ |
| D.在氯化亚铁溶液中通入氯气:Cl2+Fe2+=Fe3++2Cl- |