常温下,运用电离理论做出的预测正确的是
| A.测定某二元弱酸钠盐溶液的pH,可能小于7 |
B.稀释0.1mol/LCH3COOH(aq),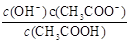 可能变大也可能变小 可能变大也可能变小 |
| C.在20.00ml浓度均为0.100 mol/L的HCl与CH3COOH混合溶液中滴加0.200mol/LNaOH溶液至pH=7,NaOH溶液体积一定小于20.00ml |
| D.pH=8的碱性溶液中一定没有CH3COOH分子 |
下列热化学方程式或离子方程式中,正确的是:
A.甲烷的标准燃烧热为-890.3kJ ·mol-1,则甲烷燃烧的热化学方程式可表示为: ·mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3kJ·mol-1 |
B.500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为: △H=-38.6kJ·mol-1 △H=-38.6kJ·mol-1 |
C.向明矾溶液中加入过量的氢氧化钡溶液: |
| D.用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性: |
2MnO + 6H+ + 5H2O2
+ 6H+ + 5H2O2 = 2Mn2+ + 5O2↑ + 8H2O
= 2Mn2+ + 5O2↑ + 8H2O
用NA表示阿伏加德罗常数,下列说法正确的是
| A.0.2 mol H2O2完全分解转移的电子数为0.4 NA |
| B.300 mL 2 mol/L蔗糖溶液中所含分子数为0.6 NA |
| C.在标准状况下,2.8 g N2和2.8 g CO所含电子数均为1.4 NA |
| D.在常温常压下,2.24 L SO2与O2混合气体中所含氧原子数为0.2 NA |
某短周期非金属元素的原子核外最外层电子数是次外层电子数的一半,该元素
| A.在自然界中只以化合态的形式存在 | B.单质常用作半导体材料和光导纤维 |
| C.最高价氧化物不与酸反应 | D.气态氢化物比甲烷稳定 |
下列说法正确的是
| A.根据反应5Fe2++MnO4ˉ+8H+=5Fe3++Mn2++4H2O可知:用酸性KMnO4溶液可检验绿矾(FeSO4·7H2O)是否变质 |
| B.根据反应3Fe+8HNO3=3Fe(NO3)3+2NO↑+4H2O可知:反应中HNO3表现酸性和氧化性 |
| C.根据反应CuSO4+H2S=CuS↓+H2SO4可知:H2S的酸性比H2SO4强 |
| D.根据反应H3PO3+2NaOH(足量)=Na2HPO3+2H2O可知:H3PO3属于三元酸 |
核内中子数为N的R2+离子,质量数为A,则n g它的氧化物中所含质子的物质的量是
A.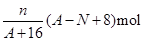 |
B.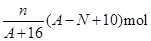 |
C.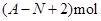 |
D.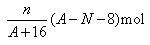 |