(本题共12分)元素周期表中ⅦA族元素的单质及其化合物的用途广泛。
23、三氟化溴(BrF3)常用于核燃料生产和后处理,遇水立即发生如下反应:3BrF3 +5H2O → HBrO3 + Br2 + 9HF+ O2 。该反应中氧化剂与还原剂的物质的量之比为 ,每生成2.24 LO2(标准状况)转移电子数为 。
24、在食盐中添加少量碘酸钾可预防缺碘。为了检验食盐中的碘酸钾,可加入醋酸和淀粉-碘化钾溶液。看到的现象是 ,相应的离子方程式是 。
氯常用作饮用水的杀菌剂,且HClO的杀菌能力比ClO-强。25℃时氯气-氯水体系中存在以下平衡关系:
Cl2(g)  Cl2(aq) ---------------①
Cl2(aq) ---------------①
Cl2(aq)+ H2O  HClO + H+ +Cl------②
HClO + H+ +Cl------②
HClO  H+ + ClO- ---------------③
H+ + ClO- ---------------③
其中Cl2(aq)、HClO和ClO-分别在三者中所占分数(α)随pH变化的关系如图所示。
25、写出上述体系中属于电离平衡的平衡常数表达式:Ki = ,由图可知该常数值为 。
26、在该体系中c(HClO) + c(ClO-) c(H+)-c(OH-)(填“大于”“小于”或“等于”)。
27、用氯处理饮用水时,夏季的杀菌效果比冬季 (填“好”或“差”),请用勒夏特列原理解释 。
A~G各物质间的关系如下图,其中B、D为气态单质.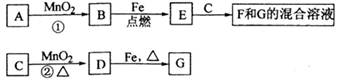
请回答下列问题:
(1)物质C和E的名称分别为________、________;
(2)可选用不同的A进行反应①若能在常温下进行,其化学方程式为________;
若只能在加热情况下进行,则反应物A应为________;
(3)反应②的化学方程式为_____________________;
(4)新配制的F溶液应加入________以防止其转化为G,检验G溶液中阳离子的常用试剂是________,实验现象为________________。
A、J是日常生活中常见的两种金属,这两种金属和NaOH组成原电池,A作负极;F常温下是气体单质,各物质有以下的转化关系(部分产物及条件略去)。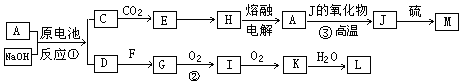
请回答以下问题:
(1)写出该原电池的总反应方程式_____________________。
(2)写出②的化学方程_________________。
(3)常温时pH=12的C溶液中,溶质的阳离子与溶质的阴离子浓度之差为。(写出计算式)
(4)若③中J的氧化物为磁性氧化物,且每生成1mol J放出Q kJ的热量,请写出A→J反应的热化学方程式。
已知A~G有如图所示的转化关系(部分生成物已略去),其中A、G为单质,D是能使湿润的红色石蕊试纸变蓝色的气体,E、F均能与NaOH溶液反应。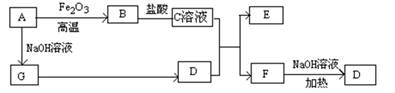
请回答下列问题:
(1)写出F的电子式;
(2)①C溶液与D反应的离子方程式为;
②F溶液与NaOH溶���共热反应的化学方程式为;
(3)①请用离子方程式解释C溶液为何显酸性;
②F溶液中离子浓度由大到小的顺序为;
(4)将5.4gA投入200mL 2.0mol/L某溶液中有G单质产生,且充分反应后有金属剩余,则该溶液可能是(填代号)
A.HNO3溶液 B.H2SO4溶液 C.NaOH溶液 D.HCl溶液
(5)将1molN2和3molG及催化剂充入容积为2L的某密闭容器中进行反应,已知该反应为放热反应。平衡时,测得D的物质的量浓度为a mol/L。
①如果反应速率v(G)=1.2mol/(L·min),则v(D)=mol/(L·min)
②在其他条件不变的情况下,若起始时充入0.5molN2和1.5molG达到平衡后,D的物质的量浓度(填“大于”、“小于”或“等于”)a/2 mol/L。
③该条件下的平衡常数为(用含a的代数式表示)
工业上以黄铜矿(主要成分CuFeS2)为原料制备金属铜,有如下两种工艺。
I.火法熔炼工艺,将处理过的黄铜矿加人石英,再通人空气进行焙烧,即可制得粗铜。
(1)焙烧的总反应式可表示为2CuFeS2+ 2SiO2+5O2=2Cu+2FeSiO3+4SO2该反应的氧化剂是。
(2)下列处理SO2的方法,不合理的是_____
A高空排放 B用纯碱溶液吸收制备亚硫酸钠
C用氨水吸收后,再经氧化制备硫酸铵D用BaCl2溶液吸收制备BaSO3
(3)炉渣主要成分有FeO、Fe2O3、SiO2、Al2O3等,为得到Fe2O3加盐酸溶解后,后续处理过程中,未涉及到的操作有。
A过滤 B加过量NaOH溶液 C蒸发结晶 D灼烧 E加氧化剂
II. FeCl3溶液浸取工艺其生产流程如下图所示
(4)浸出过程中,CuFeS2与FeCl3溶液反应的离子方程式为_____________。
(5)该工艺流程中,可以循环利用的物质是(填化学式)。
(6)若用石墨电极电解滤液,写出阳极的电极反式_____________。
(7)黄铜矿中含少量Pb,调节C1一浓度可控制滤液中Pb2+的浓度,当c(C1一)=2mo1·L-1时,溶液中Pb2+物质的量浓度为mol·L-1。[已知KSP(PbCl2)=1 x 10一5]
纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:
| 方法Ⅰ |
用炭粉在高温条件下还原CuO |
| 方法Ⅱ |
电解法,反应为2Cu + H2O  Cu2O + H2↑。 Cu2O + H2↑。 |
| 方法Ⅲ |
用肼(N2H4)还原新制Cu(OH)2 |
(1)工业上常用方法Ⅱ和方法Ⅲ制取Cu2O而很少用方法Ⅰ,其原因是反应条件不易控制,若控温不当易生成而使Cu2O产率降低。
(2)已知:2Cu(s)+1/2O2(g)=Cu2O(s)△H =-akJ·mol-1
C(s)+1/2O2(g)=CO(g)△H =-bkJ·mol-1
Cu(s)+1/2O2(g)=CuO(s)△H =-ckJ·mol-1
则方法Ⅰ发生的反应:2CuO(s)+C(s)= Cu2O(s)+CO(g);△H =kJ·mol-1。
(3)方法Ⅱ采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如图所示,该电池的阳极生成Cu2O反应式为。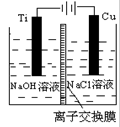
(4)方法Ⅲ为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2,该制法的化学方程式为。
(5)在相同的密闭容器中,用以上两种方法制得的Cu2O分别进行催化分解水的实验: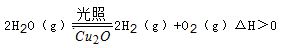
水蒸气的浓度(mol/L)随时间t(min)变化如下表所示。
| 序号 |
温度 |
0 |
10 |
20 |
30 |
40 |
50 |
| ① |
T1 |
0.050 |
0.0492 |
0.0486 |
0.0482 |
0.0480 |
0.0480 |
| ② |
T1 |
0.050 |
0.0488 |
0.0484 |
0.0480 |
0.0480 |
0.0480 |
| ③ |
T2 |
0.10 |
0.094 |
0.090 |
0.090 |
0.090 |
0.090 |
下列叙述正确的是(填字母代号)。
A.实验的温度T2小于T1
B.实验①前20 min的平均反应速率v(O2)=7×10-5 mol·L-1 min-1
C.实验②比实验①所用的催化剂催化效率高