常温下,将Cl2缓慢通入水中至饱和,然后向其中滴加0.l mol·L-l NaOH溶液。整个实验过程中溶液的pH变化曲线如图所示,不考虑次氯酸分解,下列叙述正确的是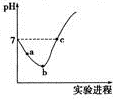
| A.实验过程中用pH试纸测定溶液的pH |
B.a~b段,溶液中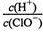 减小 减小 |
| C.b点对应溶液中:c(Cl-)> c(H+)> c(HClO) >c(ClO-)>c(OH-) |
| D.c点对应溶液中:c(Na+)=2c(ClO-)+c(HClO) |
下列溶液中的c(Cl-) 与150 mL、1 mol/L氯化铝溶液中的c(Cl-) 相等的是:
| A.150 mL、1 mol/L氯化钠溶液 | B.25 mL、3 mol/L氯化铵溶液 |
| C.75 mL、2 mol/L氯化镁溶液 | D.75 mL、2 mol/L氯化铁溶液 |
下列各组物质中,不能发生离子反应的是
| A.K2CO3溶液与盐酸 | B.稀硫酸与BaCl2溶液 |
| C.KNO3溶液与NaOH溶液 | D.NaOH溶液与硝酸溶液 |
关于容量瓶的使用,下列操作正确的是
| A.使用前要检验容量瓶是否漏液 |
| B.用蒸馏水润洗后必须要将容量瓶烘干 |
| C.为了便于操作,浓溶液稀释或固体溶解可直接在容量瓶中进行 |
| D.为了使所配溶液浓度均匀,定容结束后,手握瓶颈,左右来回振荡 |
在氢氧化铁胶体中逐滴滴入下列某种溶液,先出现沉淀,后沉淀溶解。这种溶液是
| A.三氯化铁溶液 | B.饱和硫酸镁溶液 | C.稀盐酸 | D.饱和硫酸铵溶液 |
下列实验装置图所示的实验操作,不能达到相应的实验目的的是