已知反应X(g)+Y(g)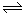 R(g)+Q(g)的平衡常数与温度的关系如下表。830℃时,向一个2L的密闭容器中充入0.2 molX和0.8 mol Y,反应初始4s内v(X)=0.005mol/(L·s)下列说法正确的是
R(g)+Q(g)的平衡常数与温度的关系如下表。830℃时,向一个2L的密闭容器中充入0.2 molX和0.8 mol Y,反应初始4s内v(X)=0.005mol/(L·s)下列说法正确的是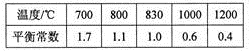
| A.4s时容器内c(Y)="0.76" mol/L |
| B.830℃达平衡时,X的转化率为80% |
| C.反应达平衡后,升高温度,平衡正向移动 |
D.1 200℃时反应R(g)+Q(g) 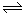 X(g)+Y(g)的平衡常数K=0.4 X(g)+Y(g)的平衡常数K=0.4 |
某硝酸盐受热分解生成金属氧化物、二氧化氮和氧气,若生成的二氧化氮和氧气的物质的量之比为8∶1,则金属元素的化合价在反应过程中的变化是( )
| A.升高 | B.降低 |
| C.不变 | D.无法确定 |
有一种磷的结构式是 ,有关它的下列叙述不正确的是( )
,有关它的下列叙述不正确的是( )
| A.它完全燃烧时的产物是P2O5 |
| B.它不溶于水 |
| C.它在常温下呈固态 |
| D.它与白磷互为同分异构体 |
关于磷的下列叙述正确的是( )
| A.红磷没有毒性而白磷有剧毒 |
| B.白磷在空气中加热到260 ℃可转变为红磷 |
| C.白磷可用于制造安全火柴 |
| D.少量白磷应保存在水中 |
砷为第4周期ⅤA元素,根据砷元素在元素周期表中的位置推测,砷不可能具有的性质是( )
| A.砷在通常状况下为固体 |
| B.As2O3对应水化物的酸性比H3PO4弱 |
| C.可以有-3、+3、+5等多种化合价 |
| D.砷的还原性比磷弱 |
锗酸铋(简称BGO)是我国研制成功的一种性能优良的闪烁晶体材料,其中Ge元素处于最高价态,铋元素的价态与它跟氯形成某些共价化合物所呈的价态相同,且此氯化物中铋具有8电子稳定结构,可表示为[BixGeyOz]n。则式中x等于()
| A.2z-4y |
B.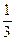 (2z-4y) (2z-4y) |
C.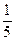 (2z-4y) (2z-4y) |
D.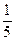 (2z-3y) (2z-3y) |