常温下,下列关于电解质溶液的说法正确的是
| A.将pH=4的CH3COOH溶液加水稀释10倍,溶液中各离子浓度均减小 |
| B.用 CH3COOH溶液滴定等物质的量浓度的NaOH溶液至pH=7,V(CH3COOH溶液)<V(NaOH溶液) |
| C.向0.2 mol/L的盐酸溶液中加入等体积0.1 mol·L-1 NH3·H2O溶液:c(Cl–)+c(OH–)=c(H+)+c(NH3·H2O) |
| D.在含0.1mol NaHSO4的溶液中:c(H+)=c(SO42-)+c(OH–) |
化学与生活、社会密切相关。下列说法不正确的是
A.利用太阳能 等清洁能源代替化石燃料,有利于节约资源、保护环境 等清洁能源代替化石燃料,有利于节约资源、保护环境 |
| B.凡含有食品添加剂的食物对人体健康均有害,不可食用 |
| C.为防止电池中的重金属等污染土壤和水体,应积极开发废电池的综合利用技术 |
| D.提倡人们购物时不用塑料袋,是为了防止白色污染 |
下图装置(Ⅰ)是一种可充电电池,装置(Ⅱ)为电解池。
装置(Ⅰ)的离子交换膜只允许Na+通过,已知电池充放电的化学方程式为 。当闭合开关K时,X电极附近溶液变红。下列说法正确的是
。当闭合开关K时,X电极附近溶液变红。下列说法正确的是
| A.闭合开关K时,钠离子从右到左通过离子交换膜 |
| B.闭合开关K时,负极反应式为:3NaBr-2e-=NaBr3+2Na+ |
| C.闭合开关K时,X电极反应式为:2Cl--2e-=Cl2↑ |
| D.闭合开关K时,当有0.1molNa+通过离子交换膜,X电极上析出标准状况下气体1.12L |
在5ml0.05mol/L的某金属氯化物的溶液中,滴加
0.1mol/LAgNO3溶液,生成沉淀的质量与加入AgNO3溶液的体积关系如图所示,则该氯化物中金属元素的化合价为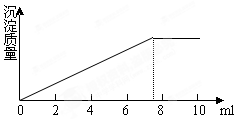
| A.+1 | B.+2 | C.+3 | D.+4 |
用石墨电极电解NaBr的水溶液时,下列叙述不正确的是
| A.电解时阳极得到Br2,阴极得到NaOH和H2 |
| B.若取阳极附近的溶液中滴入淀粉溶液,溶液呈蓝色 |
| C.若取阴极附近的溶液中滴入酚酞试液,溶液变红色 |
| D.若取阳极附近的溶液少量于试管中,滴入少量的苯,振荡静置后上层溶液呈橙红色 |
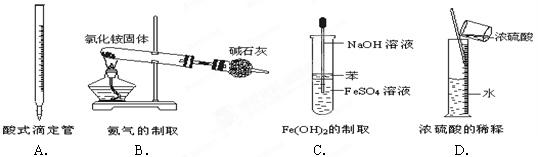
下图所示对实验仪器名称的标注或实验操作正确的是