室温下,下列溶液中粒子浓度大小关系正确的是
| A.0.1mol/LNaHCO3溶液与0.1mol/LNaOH溶液等体积混合,所得溶液中:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-) |
| B.pH相同的①CH3COONa②NaHCO3③NaAlO2三份溶液中的c(Na+):②>③>① |
| C.0.1mol•L-1的硫化钠溶液中:c(OH-)=c(H+)+c(HS-)+c(H2S) |
| D.上图中a点溶液中各离子浓度的关系是:c(OH-)=c(H+)+c(CH3COO-)+2c(CH3COOH) |
在2 L的密闭容器中,发生以下反应:2A(g) + B(g)  2C(g) + D(g)。若最初加入的A和B都是3 mol,在前10 sA的化学反应速率为0.12 mol/(L·s),则10 s时,容器中B的物质的量是
2C(g) + D(g)。若最初加入的A和B都是3 mol,在前10 sA的化学反应速率为0.12 mol/(L·s),则10 s时,容器中B的物质的量是
| A.0.6 mol | B.1.2 mol | C.2.4 mol | D.1.8 mol |
25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb2+(aq)⇌Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示.下列判断正确的是()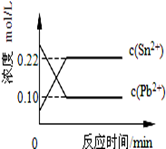
| A.往平衡体系中加入金属铅后,C(Pb2+)增大 |
| B.往平衡体系中加入少量Sn(NO3)2固体后,c(Pb2+)变小 |
| C.升高温度,平衡体系中c(Pb2+)增大,说明该反应△H>0 |
| D.25℃时,该反应的平衡常数K=2.2 |
100℃时,将0.1 mol N2O4置于1 L密闭的烧瓶中,然后将烧瓶放入100℃的恒温槽中,烧瓶内的气体逐渐变为红棕色:N2O4(g)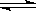 2NO2 (g)。下列结论不能说明上述反应在该条件下已经达到反应限度的是
2NO2 (g)。下列结论不能说明上述反应在该条件下已经达到反应限度的是
| A.N2O4的消耗速率与NO2的生成速率之比为1∶2; |
| B.烧瓶内气体的颜色不再加深; |
| C.烧瓶内气体的平均相对分子质量不再变化; |
| D.烧瓶内气体的压强不再变化。 |
25 ℃时,在等体积的①pH=0的H2SO4溶液,②0.05 mol·L-1的Ba(OH)2溶液中,发生电离的水的物质的量之比是()
| A.1∶10 | B.1∶5 | C.1∶20 | D.1∶10 |
下列有关化学平衡常数K的说法中,正确的是( )
| A.K的大小与起始浓度有关 |
| B.温度越高,K值越大 |
| C.K值越大,反应物的转化率越大 |
| D.K值越大,正向反应进行的程度越小 |